题目内容
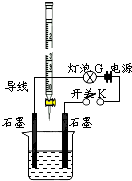 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.(1)实验时,滴定管中应盛
(2)若A为一元强酸,B为一元强碱,且a+b=14.该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、…20).
断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为
(3)若A为强酸,B为强碱,且a+b=14.断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液.此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
考点:性质实验方案的设计
专题:
分析:(1)根据根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液;
(2)根据该温度下的水的离子积判断两溶液反应后溶液酸碱性及溶液中离子浓度大小,从而判断溶液导电性大小;根据水的离子积计算出中性溶液中氢离子浓度,再计算出溶液的pH;
(3)根据电荷守恒判断溶液中阳离子浓度大于阴离子浓度原因;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱;从盐类的水解以及电荷守恒角度分析,注意两者等体积混合后溶液显碱性的信息.
(2)根据该温度下的水的离子积判断两溶液反应后溶液酸碱性及溶液中离子浓度大小,从而判断溶液导电性大小;根据水的离子积计算出中性溶液中氢离子浓度,再计算出溶液的pH;
(3)根据电荷守恒判断溶液中阳离子浓度大于阴离子浓度原因;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱;从盐类的水解以及电荷守恒角度分析,注意两者等体积混合后溶液显碱性的信息.
解答:
解:(1)根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液,故答案为:A;
(2)该温度下,水的离子积Kw=l×10-14,a+b=14的一元强酸和一元强碱等体积混合,溶液呈中性,反应后的溶液为盐溶液,由于体积变成原先的2倍,离子浓度则变为原先的
,所以溶液的导电性为5;根据水的离子积可知,该温度下,中性溶液中氢离子浓度为:l×10-7mol/L,溶液的pH=7,
故答案为:5;反应后烧杯中自由离子的浓度约为原溶液的一半;7;
(3)当溶液呈中性时,有电荷守恒可知,溶液中阳离子所带电荷总浓度应该等于阴离子所带负电荷总浓度,而现在阳离子浓度大于阴离子浓度,可知1个阴离子所带电荷大于1个阳离子所带电荷,即A为多元强酸,
故答案为:A为多元强酸;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱存在电离平衡,则混合溶液中必定是M+离子能发生水解,反应的离子方程式为:M++H2O?MOH+H+;
易判断⑤是正确的电荷守恒关系式,由于溶液呈碱性,故c(OH-)>c(H+),排除①、③,
根据c(OH-)>c(H+)和c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),
由于OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),即④正确.若HR是强酸,此时溶液中不再有HR分子,此时②即是错误的,由于混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),这与题意“溶液呈碱性”不符,故⑥是错误的,
故答案为:M++H2O?MOH+H+;④⑤.
(2)该温度下,水的离子积Kw=l×10-14,a+b=14的一元强酸和一元强碱等体积混合,溶液呈中性,反应后的溶液为盐溶液,由于体积变成原先的2倍,离子浓度则变为原先的
| 1 |
| 2 |
故答案为:5;反应后烧杯中自由离子的浓度约为原溶液的一半;7;
(3)当溶液呈中性时,有电荷守恒可知,溶液中阳离子所带电荷总浓度应该等于阴离子所带负电荷总浓度,而现在阳离子浓度大于阴离子浓度,可知1个阴离子所带电荷大于1个阳离子所带电荷,即A为多元强酸,
故答案为:A为多元强酸;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱存在电离平衡,则混合溶液中必定是M+离子能发生水解,反应的离子方程式为:M++H2O?MOH+H+;
易判断⑤是正确的电荷守恒关系式,由于溶液呈碱性,故c(OH-)>c(H+),排除①、③,
根据c(OH-)>c(H+)和c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),
由于OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),即④正确.若HR是强酸,此时溶液中不再有HR分子,此时②即是错误的,由于混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),这与题意“溶液呈碱性”不符,故⑥是错误的,
故答案为:M++H2O?MOH+H+;④⑤.
点评:本题考查了影响溶液导电性因素、强弱电解质的判断,题目难度较大,注意掌握影响溶液导电性因素,易错点为(4),注意溶液离子浓度大小比较的方法,尤其注意解答该题须知:①25℃时,pH之和为14的酸、碱溶液等体积混合,谁弱显谁性,无弱显中性(原因是:二者反应后,弱者有大量剩余,所以弱者电离显性).

练习册系列答案
相关题目
将16mL NO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3?5N2+6H2O(g).已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是 ( )
①3:1②3:2③3:3 ④3:4⑤3:5.
①3:1②3:2③3:3 ④3:4⑤3:5.
| A、①② | B、①⑤ | C、②③④ | D、④⑤ |
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该有机物属于烃 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、无色溶液:Ca2+、H+、Cl-、HSO3 - | ||
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 - | ||
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3 - | ||
D、
|
下列各组离子在指定溶液中能大量共存的是( )
| A、滴入甲基橙显红色的溶液中:K+、Al3+、I-、ClO-、NO3- |
| B、常温下,某溶液pH=1的溶液中含有:NO3-、NH4+、Fe2+、SO42- |
| C、常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
| D、0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据如图化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据如图化学反应框图填空: 如图中的实验装置可以用于实验室制取乙炔.请填空.
如图中的实验装置可以用于实验室制取乙炔.请填空.