题目内容
20.下列各组离子,在强碱性溶液中可以大量共存的是( )| A. | K+、Na+、HSO3-、Cl- | B. | H+、Al3+、Fe3+、I- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、Ba2+、AlO2-、NO3- |
分析 溶液呈碱性,则应存在大量的OH-,与OH-反应的离子不能大量存在,以此解答该题.
解答 解:A.HSO3-与OH-反应不能大量共存,故A错误;
B.H+、OH-生成水,Al3+、Fe3+与OH-反应生成沉淀,酸性条件下Fe3+、I-发生氧化还原反应,不能大量共存,故B错误;
C.NH4+ 与OH-反应而不能的电离共存,故C错误;
D.碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存,为高考常见题型,侧重于学生学生元素化合物知识的综合运用,难度不大,注意把握题给信息以及相关离子的性质.

练习册系列答案
相关题目
10.电解法降解NO3-的原理如图所示,电解总反应为4NO3-+4H+$\frac{\underline{\;通电\;}}{\;}$2N2↑++5O2↑+2H2O.下列说法正确的是( )

| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |
8.在指定环境中,下列各组离子可以大量共存的是( )
| A. | 加入铝片立即放出氢气的溶液中:C1-、K+、NH4+、NO3- | |
| B. | 滴加石蕊试液呈红色的溶液中:CO32-、K+、ClO-、OH- | |
| C. | pH=13的溶液中:HCO3-、Na+、NO3-、SO42 | |
| D. | 在pH=3的溶液中:NH4+、Ca2+、C1-、K+ |
15.下列说法不正确的是( )
| A. | 在“金属析氢腐蚀”实验中,外面缠绕着铜丝的铁钉上产生气泡多,周围先出现蓝色 沉淀(溶液中滴加几滴K3[Fe(CN)6]溶液) | |
| B. | 在Zn-Cu稀H2SO4构成的原电池中,用海绵隔离Zn片和Cu片,其目的是降低电极之间的内阻,增强放电效率 | |
| C. | 在Zn-Cu稀H2SO4构成的原电池中,溶液中加入适量H2O2,其目的是降低电极的极化作用,提高电池的放电效率 | |
| D. | 用两根铜棒电解饱和食盐水:2C1-+2H2O电解2OH-+H2↑+C12↑ |
5.室温条件下进行如表各组实验,其中的观察要点不能说明醋酸是弱电解质的是( )
| 选项 | 实验方案 | 观察要点 |
| A | 等浓度的醋酸与氢氧化钠溶液反应 | 恰好反应时的体积比 |
| B | 醋酸溶液中加入醋酸钠固体 | 溶液pH的变化 |
| C | 等体积等浓度的盐酸和醋酸分别和等量镁条反应 | 产生H2的起始速率 |
| D | 将pH=4的醋酸稀释成PH=6的溶液 | 加H2O的量 |
| A. | A | B. | B | C. | C | D. | D |
12.芳香化合物M的结构简式为  关于有机物M的说法正确的是( )
关于有机物M的说法正确的是( )
 关于有机物M的说法正确的是( )
关于有机物M的说法正确的是( )| A. | 有机物M的分子式为C10H12O3 | |
| B. | 1 mol Na2CO3最多能消耗1 mol有机物M | |
| C. | 1 mol M和足量金属钠反应生成22.4 L气体 | |
| D. | 有机物M能发生取代、氧化、还原和加聚反应 |

 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;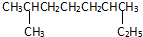 的系统命名是:2,6-二甲基辛烷;
的系统命名是:2,6-二甲基辛烷;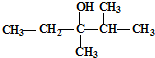 的键线式是
的键线式是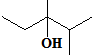 ;
;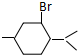 的分子中含有3个手性碳原子;
的分子中含有3个手性碳原子; .
.