题目内容
2NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、32g氧气所含分子数为2NA |
| B、在常温常压下,1mol氦气含有的原子数为NA |
| C、在常温常压下,11.2L氯气含有的分子数为0.5NA |
| D、2.3gNa在空气中燃烧时,消耗氧气的分子数为0.025NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、32g氧气的物质的量为:
=1mol;
B、稀有气体为单原子分子,1mol氦气中含有1mol氦原子;
C、不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量;
D、2.3g钠的物质的量为0.1mol,完全反应0.1mol钠消耗0.5mol氧气.
| 32g |
| 32g/mol |
B、稀有气体为单原子分子,1mol氦气中含有1mol氦原子;
C、不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量;
D、2.3g钠的物质的量为0.1mol,完全反应0.1mol钠消耗0.5mol氧气.
解答:
解:A、32g氧气的物质的量为1mol,所含分子数为NA,故A错误;
B、1mol氦气中含有1mol氦原子,1mol氦气含有的原子数为NA,故B正确;
C、常温下,不是标况下,题中条件无法计算11.2L氯气的物质的量,故C错误;
D、2.3g钠的物质的量为0.1mol,0.1mol钠完全反应需要消耗氧气0.05mol,消耗氧气的分子数为0.05NA,故D错误;
故选B.
B、1mol氦气中含有1mol氦原子,1mol氦气含有的原子数为NA,故B正确;
C、常温下,不是标况下,题中条件无法计算11.2L氯气的物质的量,故C错误;
D、2.3g钠的物质的量为0.1mol,0.1mol钠完全反应需要消耗氧气0.05mol,消耗氧气的分子数为0.05NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,注意稀有气体为单原子分子,熟练掌握阿伏伽德罗常数与物质的量之间的转化关系.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,5.6 L乙醇含有0.25 NA个分子 |
| B、5.6gFe与一定量HNO3反应,一定转移0.3NA个电子 |
| C、25℃时,1.0LpH=13的NaOH溶液中含有0.1 NA个OH- |
| D、1 L0.1 mol/LFe2(SO4)3溶液中含有0.2NA个Fe3+ |
在0.1mol?L-1的CH3COONa溶液中离子浓度关系正确的是( )
| A、c(Na+)>c(OH)>c(CH3COO-)>c(H+) |
| B、c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、c(Na+)+c(CH3COO-)=c(OH-)+c(H+) |
下列反应的离子方程式正确的是( )
| A、等物质的量是Ba(OH)2与NH4HSO4的稀溶液反应:Ba2+2OH-+2H+SO42-=BaSO4↓+2H2O |
| B、向硫酸铜溶液中加入足量的氢氧化钡溶液Ba2++SO42-═BaSO4↓ |
| C、向碳酸氢钠溶液中滴入过量石灰水HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HC03-+Ca2++2OH-═MgCO3↓+MgCO3↓+2H2O |
下列离子方程式中,正确的是( )
| A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
| C、Cl2与水反应 Cl2+H2O═Cl-+ClO-+2H+ |
| D、F2与NaOH溶液反应 2F2+4OH-═4F-+O2+2H2O |
已知室温下,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A、溶液的pH=4 |
| B、HA的电离平衡常数约为l×10-7 |
| C、HA电离出的c(H+)与水电离出的c(H+)之比为10:8 |
| D、升高温度,溶液的pH减小 |
下列关于各装置图的叙述中,不正确的是( )
A、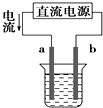 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |
若a、b、c、d均大于零,下列能正确表示燃烧热的热化学方程式为( )
| A、CH3CH2OH(l)+3O2 (g)=2CO2 (g)+3H2O(l)△H=-a kJ/mol | ||
| B、CH4 (g)+2O2 (g)=2H2O(g)+CO2(g)△H=-b kJ/mol | ||
C、H2 (g)+
| ||
| D、2CH≡CH(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-d kJ/mol |
