题目内容
5.氰气的分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )| A. | 分子中四原子共直线,是非极性分子 | |
| B. | N≡C键的键长大于C≡C键的键长 | |
| C. | 分子中含有2个σ键和4个π键 | |
| D. | 氰气不和氢氧化钠溶液发生反应 |
分析 A.直接连接三键两端原子的原子与三键两端的原子共线,正负电荷重心重合的分子为非极性分子;
B.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长;
C.共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键;
D.根据卤素单质的性质分析氰化氢的性质.
解答 解:A.直接连接三键两端原子的原子与三键两端的原子共线,正负电荷重心重合的分子为非极性分子,该反应中所有原子共线,且该分子的正负电荷重心重合,为非极性分子,故A正确;
B.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,故B错误;
C.共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键,所以氰气分子中含有3个σ键和4个π键,故C错误;
D.根据卤素性质知,卤素单质能和氢氧化钠发生加成反应,则氰分子也能与氢氧化钠发生反应,故D错误;
故选A.
点评 本题考查了物质的组成、结构和性质的关系,同时考查学生知识迁移能力,根据已知的乙炔的结构、卤素的性质结合元素周期律来分析解答即可,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.化学键是一种作用力,下列不属于化学键的是( )
| A. | 离子键 | B. | 氢键 | C. | 极性共价键 | D. | 非极性共价键 |
16.我国的“神舟五号”、“嫦娥1号”探月工程发射成功.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量.地球上氦元素主要以${\;}_{2}^{4}$He形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| B. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,金属性较强 |
13.向溶液X中持续通入气体Y,会产生“浑浊→澄清”现象的是( )
| A. | X:氯化铝溶液,Y:氨气 | |
| B. | X:硅酸钠溶液,Y:二氧化硫 | |
| C. | X:氢氧化钡溶液,Y:一氧化碳 | |
| D. | X:四羟基合铝酸钠溶液,Y:二氧化氮 |
20.下列描述中不正确的是( )
| A. | CS2为V形的极性分子 | B. | ClO3-的空间构型为三角锥形 | ||
| C. | SF6中有6对完全相同的成键电子对 | D. | PCl5和SO3均为非极性分子 |
10.用布氏漏斗和吸滤瓶接抽水泵过滤沉淀后,正确的操作是( )
| A. | 先关水龙头,拔下抽滤瓶上的橡皮管,再取下布氏漏斗 | |
| B. | 先取下布氏漏斗,再关上水龙头 | |
| C. | 先将沉淀和滤纸一起取出,再关上水龙头 | |
| D. | 先拔下抽滤瓶上的橡皮管,关上水龙头,再取下布氏漏斗 |
17.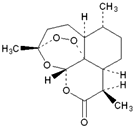 2015年我国女科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命而荣获诺贝尔奖.青蒿素结构式如图所示,下列关于青蒿素的说法不正确的是( )
2015年我国女科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命而荣获诺贝尔奖.青蒿素结构式如图所示,下列关于青蒿素的说法不正确的是( )
 2015年我国女科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命而荣获诺贝尔奖.青蒿素结构式如图所示,下列关于青蒿素的说法不正确的是( )
2015年我国女科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命而荣获诺贝尔奖.青蒿素结构式如图所示,下列关于青蒿素的说法不正确的是( )| A. | 难溶于水,易溶于乙醚 | B. | 在热的NaOH溶液中可发生水解反应 | ||
| C. | 一定条件下能与氯气发生取代反应 | D. | 化学式为C15H21O5 |
14.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应A(s)+2B(g)?C(g)+D(g)已经到达平衡的是( )
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 当B、C、D三种物质,它们的物质的量nB:nC:nD=2:1:1 | |
| D. | 混合气体的总物质的量 |
15.下列关于Cs描述中,错误的是( )
| A. | CsOH是一种既可与强酸又可与强碱反应的两性氢氧化物 | |
| B. | Cs在空气中燃烧可生成Cs2O和Cs2O2 | |
| C. | Cs与水反应,能发生爆炸,并放出H2 | |
| D. | CsOH很稳定,加热不易分解 |