题目内容
14.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应A(s)+2B(g)?C(g)+D(g)已经到达平衡的是( )| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 当B、C、D三种物质,它们的物质的量nB:nC:nD=2:1:1 | |
| D. | 混合气体的总物质的量 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边气体计量数相等,压强始终不变,故A错误;
B、混合气体的密度,说明气体的质量不变,反应达平衡状态,故B正确;
C、当体系达平衡状态时,B、C和D的物质的量之比可能2:1:1,也可能不是,与各物质的初始浓度及转化率有关,故C错误;
D、两边气体计量数相等,混合气体的总物质的量始终不变,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
4.在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H1; 2H2(g)+O2(g)=2H2O(g)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
5.氰气的分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A. | 分子中四原子共直线,是非极性分子 | |
| B. | N≡C键的键长大于C≡C键的键长 | |
| C. | 分子中含有2个σ键和4个π键 | |
| D. | 氰气不和氢氧化钠溶液发生反应 |
2.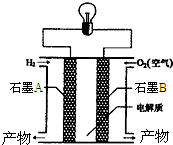 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | B电极上发生氧化反应 | |
| B. | A电极是负极 | |
| C. | 该电池的总反应为2H2+O2=2H2O | |
| D. | 外电路中电子由A电极通过导线流向B电极 |
9.在CH3COOH?H++CH3COO-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
19.下列电子式书写不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
6.下列各组物质中化学键的类型相同的是( )
| A. | HF MgCl2 NH4Cl | B. | H2S Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH C H4 | D. | NH3 H2O CS2 |
3.下列事实不能用分子间作用力解释的是( )
| A. | HF、H2O的沸点比HCl、H2S的沸点高很多 | |
| B. | 正戊烷的沸点比新戊烷的沸点高 | |
| C. | 邻羟基苯甲酸的沸点比对羟基苯甲酸的低 | |
| D. | Na2O的熔点比MgO的熔点低 |
4.下列说法中正确的是( )
| A. | 金属Li、Na、K密度较小,应保存在煤油中 | |
| B. | CuO、Na2O、Mn2O7属于碱性氧化物 | |
| C. | SO2具有漂白性,可使溴水褪色 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4会产生沉淀而后沉淀溶解 |