题目内容
20.下列描述中不正确的是( )| A. | CS2为V形的极性分子 | B. | ClO3-的空间构型为三角锥形 | ||
| C. | SF6中有6对完全相同的成键电子对 | D. | PCl5和SO3均为非极性分子 |
分析 A.CS2 中C原子孤电子对数=$\frac{4-2×2}{2}$=0,价层电子对数=2+0=2,为直线形对称结构;
B.ClO3-中Cl原子孤电子对数=$\frac{7+1-2×3}{2}$=1,价层电子对数=3+1=4;
C.SF6中含有6个完全相同的S-F键;
D.对应ABn型分子,中心原子最外层电子全部参与成键,该分子为非极性分子.
解答 解:A.CS2 中C原子孤电子对数=$\frac{4-2×2}{2}$=0,价层电子对数=2+0=2,为直线形对称结构,属于非极性分子,故A错误;
B.ClO3-中Cl原子孤电子对数=$\frac{7+1-2×3}{2}$=1,价层电子对数=3+1=4,空间构型为三角锥形,故B正确;
C.SF6中含有6个S-F键,化学键完全相同,故C正确;
D.PCl5和SO3电子中P、S原子最外层电子全部参与成键,均为非极性分子,故D正确.
故选:A.
点评 本题考查微粒空间构型判断、分子极性、化学键等,区别分子极性与化学键极性,注意对基础知识的理解掌握.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
10.现有部分前四周期元素的性质或原子结构如表:
(1)写出元素E+基态原子的电子排布式:1s22s22p63s23p63d10.
(2)ABCD四种元素电负性由大到小排列顺序为(用元素符号表示)O>N>C>Si
(3)B单质分子中,含有σ键和π键的个数比是1:2,元素C的气态氢化物的杂化方式和空间构型分别为sp3、V形.
(4)以上元素组成的化合物中心原子是sp杂化方式的是CO2(化学式)
(5)A、B、C、D第一电离由大到小的顺序为(用元素符号表示):N>O>C>Si.
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
(2)ABCD四种元素电负性由大到小排列顺序为(用元素符号表示)O>N>C>Si
(3)B单质分子中,含有σ键和π键的个数比是1:2,元素C的气态氢化物的杂化方式和空间构型分别为sp3、V形.
(4)以上元素组成的化合物中心原子是sp杂化方式的是CO2(化学式)
(5)A、B、C、D第一电离由大到小的顺序为(用元素符号表示):N>O>C>Si.
11.下列递变情况中正确的是( )
| A. | HF、HCl、HBr、HI的沸点依次升高 | B. | HF、HCl、HBr、HI还原性依次增强 | ||
| C. | HF、HCl、HBr、HI稳定性依次增强 | D. | HF、HCl、HBr、HI酸性依次增强 |
8.下列化学电池不易造成环境污染的是( )
| A. | 氢氧燃料电池 | B. | 干电池 | C. | 铅蓄电池 | D. | 锌锰电池 |
15.下列反应的化学方程式或离子方程式正确的是( )
| A. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 氯化铝溶液和过量氨水反应:Al3++3NH3•H2O═3NH4++Al (OH)3↓ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
5.氰气的分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A. | 分子中四原子共直线,是非极性分子 | |
| B. | N≡C键的键长大于C≡C键的键长 | |
| C. | 分子中含有2个σ键和4个π键 | |
| D. | 氰气不和氢氧化钠溶液发生反应 |
12.下列关于实验原理或操作的叙述中,不正确的是( )
| A. | 从溴水中提取单质溴时,不能用无水乙醇代替CCl4 | |
| B. | 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 | |
| C. | 用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 | |
| D. | 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 |
9.在CH3COOH?H++CH3COO-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
10.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.
(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2
(3)M和R形成的化合物遇水会发生剧烈的反应,反应的化学方程式为Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,反应后的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
③据报道,“L5+”是带正电荷的分子碎片,它的结构尚不清楚.其结构应该是对称的,5个L排成V形,且都达到8电子结构.则L5+可能的结构式是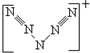 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
| J | ||||
| R |
 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2
(3)M和R形成的化合物遇水会发生剧烈的反应,反应的化学方程式为Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,反应后的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.