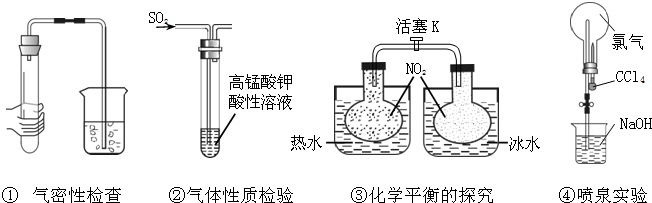
题目内容
下列实验装置或操作正确的是( )
A、 向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、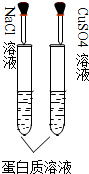 两支试管中蛋白质溶液均会变性 |
C、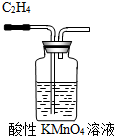 除去C2H4中的SO2 |
D、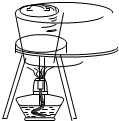 海带灼烧成灰 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.二氧化碳与AlO2-、SiO32-及苯酚钠等均可反应生成白色沉淀;
B.重金属盐可使蛋白质变性;
C.乙烯、二氧化硫均能被高锰酸钾氧化;
D.在坩埚中进行灼烧操作.
B.重金属盐可使蛋白质变性;
C.乙烯、二氧化硫均能被高锰酸钾氧化;
D.在坩埚中进行灼烧操作.
解答:
解:A.通入过量CO2能出现白色沉淀的溶液还可能有SiO32-,故A错误;
B.加CuSO4溶液能使蛋白质变性,加NaCl使蛋白质盐析,故B错误;
C.酸性KMnO4溶液不但能氧化除去SO2,也会氧化C2H4,应选择NaOH溶液来除杂,故C错误;
D.海带的灼烧用坩埚直接加热即可,图中操作合理,故D正确;
故选D.
B.加CuSO4溶液能使蛋白质变性,加NaCl使蛋白质盐析,故B错误;
C.酸性KMnO4溶液不但能氧化除去SO2,也会氧化C2H4,应选择NaOH溶液来除杂,故C错误;
D.海带的灼烧用坩埚直接加热即可,图中操作合理,故D正确;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及离子反应、蛋白质的性质、氧化还原反应及除杂、灼烧操作等,注重高频考点的考查,注意化学反应原理的应用及实验的评价性分析,把握装置图的作用,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
化学与社会、生产、生活密切相关.下列说法正确的是( )
| A、棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
| B、工业上获得大量的乙烯、丙烯、丁二烯的方法是石油裂化 |
| C、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
| D、神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
下列事实不能用平衡移动原理解释的是( )
| A、钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B、用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C、蒸馏水和0.1mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D、向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,最外层电子数之和为19.A的周期数等于族序数,在短周期中D元素的原子半径最大,C与E质子数之比为1:2,B与C形成的化合物在大气中排放易产生光化学烟雾.则下列说法正确的是( )
| A、B的气态氢化物稳定性较C的强 |
| B、C与D形成的一种化合物与水反应能产生C2单质 |
| C、均由A、C、D、E四种元素形成的两种盐不能相互反应 |
| D、B的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为共价化合物 |
NA为阿伏伽德罗常数.下列说法正确的是( )
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA |
| C、1L 1.0mol?L-1 NH4Cl与2L 0.5mol?L-1 NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA |
NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B、0.1mol 24Mg32S晶体中所含中子总数为2.8NA |
| C、常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L |
| D、在熔融状态下,1mol NaHSO4完全电离出的阳离子数目为2NA |