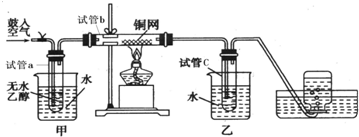
题目内容
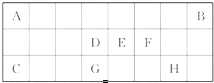 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.(1)上述元素中形成化合物种类最多的是
(2)D的氢化物比G的氢化物稳定,其原因是
(3)在一定条件下,A与E形成的气态化合物溶于水后溶液呈
(4)现有另一种元素X,其原子得电子能力最强,则X在周期表中的位置
(5)“神舟六号”载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的
(6)写出由以上任意两种元素组成的只含共价键的物质的化学式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:该周期表中元素是短周期元素,根据元素在周期表中的位置知,A、B、C、D、E、F、G、H分别是H、He、Na、C、N、O、Si、Cl元素,
(1)形成化合物种类最多的是C元素,原子半径最大的元素在周期表左下角,离子半径最大的是Cl元素,最高价氧化物的水化物酸性最强的是高氯酸;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)氨气水溶液呈碱性;
(4)得电子能力最强的元素其非金属性最强,位于元素周期表右上角(稀有气体除外);
(5)能供给人呼吸的物质是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(6)非金属元素之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键,稀有气体中不存在化学键.
(1)形成化合物种类最多的是C元素,原子半径最大的元素在周期表左下角,离子半径最大的是Cl元素,最高价氧化物的水化物酸性最强的是高氯酸;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)氨气水溶液呈碱性;
(4)得电子能力最强的元素其非金属性最强,位于元素周期表右上角(稀有气体除外);
(5)能供给人呼吸的物质是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(6)非金属元素之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键,稀有气体中不存在化学键.
解答:
解:该周期表中元素是短周期元素,根据元素在周期表中的位置知,A、B、C、D、E、F、G、H分别是H、He、Na、C、N、O、Si、Cl元素,
(1)形成化合物种类最多的是C元素,原子半径最大的Na,离子半径最大的是Cl元素,最高价氧化物的水化物酸性最强的是HClO4,故答案为:碳;钠;氯;HClO4;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性C>Si,所以D的氢化物比G的氢化物稳定,故答案为:C的非金属性比Si的非金属性强;
(3)NH3+H2O?NH3.H2O?NH4++OH-,所以氨气水溶液呈碱性,故答案为:碱;
(4)得电子能力最强的元素其非金属性最强,位于元素周期表右上角(稀有气体除外),为F元素,F位于第二周期第VIIA族,故答案为:第二周期第VIIA族;
(5)能供给人呼吸的物质是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:C和F;2Na2O2+2CO2=2Na2CO3+O2;
(6)由以上任意两种元素组成的只含共价键的物质的化学式为HCl,只含离子键的物质的化学式NaCl,既含离子键又含共价键的物质Na2O2,不含化学键的物质的化学式He,
故答案为:HCl;NaCl;Na2O2;He.
(1)形成化合物种类最多的是C元素,原子半径最大的Na,离子半径最大的是Cl元素,最高价氧化物的水化物酸性最强的是HClO4,故答案为:碳;钠;氯;HClO4;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性C>Si,所以D的氢化物比G的氢化物稳定,故答案为:C的非金属性比Si的非金属性强;
(3)NH3+H2O?NH3.H2O?NH4++OH-,所以氨气水溶液呈碱性,故答案为:碱;
(4)得电子能力最强的元素其非金属性最强,位于元素周期表右上角(稀有气体除外),为F元素,F位于第二周期第VIIA族,故答案为:第二周期第VIIA族;
(5)能供给人呼吸的物质是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:C和F;2Na2O2+2CO2=2Na2CO3+O2;
(6)由以上任意两种元素组成的只含共价键的物质的化学式为HCl,只含离子键的物质的化学式NaCl,既含离子键又含共价键的物质Na2O2,不含化学键的物质的化学式He,
故答案为:HCl;NaCl;Na2O2;He.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及化学键、氧化还原反应、元素周期表结构等知识点,根据物质的构成微粒、元素周期表结构及元素周期律等知识点来分析解答,注意:稀有气体是单原子分子,不含化学键,为易错点.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,最外层电子数之和为19.A的周期数等于族序数,在短周期中D元素的原子半径最大,C与E质子数之比为1:2,B与C形成的化合物在大气中排放易产生光化学烟雾.则下列说法正确的是( )
| A、B的气态氢化物稳定性较C的强 |
| B、C与D形成的一种化合物与水反应能产生C2单质 |
| C、均由A、C、D、E四种元素形成的两种盐不能相互反应 |
| D、B的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为共价化合物 |
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
警察常从案发现场的人体气味来获取有用的线索,人体气味的成分中含有多种有机物,比如:
①十八烷
②环十二醇,
关于这二种有机物,下列说法不正确的是( )
①十八烷
②环十二醇,
关于这二种有机物,下列说法不正确的是( )
| A、①和②分子中碳原子数大于10 |
| B、①和②常温常压下不为气态 |
| C、①和②均能与Na反应放出氢气 |
| D、②的分子式为C12H24O |
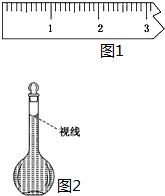 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.