题目内容
20.薛文同学通过查询资料知道,一定浓度的硝酸与Mg反应时,可同时得到NO2、NO、N2三种气体.该同学欲用下列仪器组装装置来直接验证有NO2、NO生成并制取氮化镁.(假设实验中每步转化均是完全的)查阅文献得知:①NO2沸点为21.1℃、熔点为-11℃,NO沸点为-151℃、熔点为-164℃;
②镁也能与CO2反应;
③氮化镁遇水剧烈水解生成Mg(OH)2和氨气.
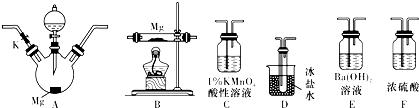
(1)实验中先打开开关K,通过导管向装置内通入CO2气体以排出装置内的空气,停止通入CO2的标志是E中出现白色沉淀.
(2)为实现上述实验目的,所选用的仪器的正确连接方式是:A→D→C→F→B→F→E,确定还原产物中有NO2的现象是A中有红棕色气体产生(或D中出现有色液体),实验中要多次使用装置F,第二次使用F的目的是防止水蒸气进入B导致氮化镁水解.
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式.5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O
(4)薛文同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是装置中充满CO2,而加热时CO2也能与Mg反应.
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成取少量B中反应后的固体放入试管中,再向试管中滴加适量的水并将湿润的红色石蕊试纸靠近试管口处,试纸变蓝.
分析 探究一定浓度的硝酸与Mg反应产物:A三颈烧瓶中为镁和硝酸反应,可能得到NO2、NO、N2三种气体,若二氧化氮气体,A中有红棕色气体产生,NO2沸点为21.1℃,经过D装置冰盐水冷却生成的气体,D中出现有色液体,C中盛放1%的酸性高锰酸钾,若出现高锰酸钾褪色,说明有NO生成,氧化反应为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,经过装置F进行气体干燥,然后进入装置B进行镁和氮气的反应,再经过装置F,防止水蒸气进入B导致氮化镁水解,最后用氢氧化钡吸收尾气.
(1)E装置在该实验中为吸收尾气装置,实验中先打开开关K,通过导管向装置内通入CO2气体以排出装置内的空气,当E中出现白色沉淀,说明二氧化碳已经充满整个装置;
(2)根据实验装置中的药品及实验的目的确定所选用的仪器的正确连接方式,二氧化氮为红棕色气体,确定还原产物中有NO2的现象是A中有红棕色气体产生(或D中出现有色液体),氮化镁易水解,第二次使用F的目的是防止水蒸气进入B导致氮化镁水解;
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,为NO和高锰酸根离子反应氧化还原反应,根据质量守恒和得失电子守恒配平;
(4)根据镁能和二氧化碳反应分析,镁条与二氧化碳反应会生成碳与氧化镁;
(5)检验氮气的生成,可通过检验氮气和镁反应的产物氮化镁,氮化镁易水解生成氢氧化镁和氨气,根据检验氨气的存在间接检验氮气.
解答 解:(1)探究一定浓度的硝酸与Mg反应产物,E装置在该实验中为吸收尾气装置,实验中先打开开关K,通过导管向装置内通入CO2气体以排出装置内的空气,当E中出现白色沉淀,说明二氧化碳已经充满整个装置,已经全部排出装置内的空气,需停止通入CO2,
故答案为:E中出现白色沉淀;
(2)探究一定浓度的硝酸与Mg反应产物:A三颈烧瓶中为镁和硝酸反应,可能得到NO2、NO、N2三种气体,若二氧化氮气体,A中有红棕色气体产生,经过D装置冰盐水冷却生成的气体,D中出现有色液体,C中盛放1%的酸性高锰酸钾,若出现高锰酸钾褪色,说明有NO生成,氧化反应为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,经过装置F进行气体干燥,然后进入装置B进行镁和氮气的反应,再经过装置F,防止水蒸气进入B导致氮化镁水解,最后用氢氧化钡吸收尾气,所选用的仪器的正确连接方式是:A→D→C→F→B→F→E,氮化镁易水解,第二次使用F的目的是防止水蒸气进入B导致氮化镁水解,
故答案为:D→C→F→B→F;防止水蒸气进入B导致氮化镁水解;
(3)C中溶液颜色慢慢褪去,为NO和高锰酸根离子反应氧化还原反应,该反应中,反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;NO→NO3-,N由+2价变成+5价,一个NO分子失去3个电子,所以其最小公倍数为15,故MnO4-的计量数为3,NO的计量数为5,然后根据原子守恒配平其它元素,配平后的离子方程式为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,
故答案为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O;
(4)镁条与二氧化碳发生置换反应,生成碳与氧化镁,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,所以在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是装置中充满CO2,而加热时CO2也能与Mg反应,
故答案为:装置中充满CO2,而加热时CO2也能与Mg反应;
(5)镁与硝酸反应时若有氮气生成,则生成的氮气和镁反应生成氮化镁,氮化镁易水解生成氨气,所以取少量B中反应后的固体放入试管中,再向试管中滴加适量的水并将湿润的红色石蕊试纸靠近试管口处,试纸变蓝,说明有氮气生成,
故答案为:取少量B中反应后的固体放入试管中,再向试管中滴加适量的水并将湿润的红色石蕊试纸靠近试管口处,试纸变蓝.
点评 本题考查反应产物的测定、对实验原理与装置的理解、实验方案设计等,题目难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 不变、减小 | B. | 增大、减小 | C. | 减小、增大 | D. | 不变、增大 |
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:
①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-
(Ⅰ)制备Na2S2O3•5H2O
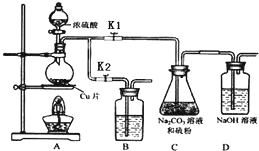
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热.圆底烧瓶中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
C中碳酸钠的作用是提供碱性环境,作反应物.D中可能发生的离子反应方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.“停止C中的反应”的操作
是打开K2,关闭K1.
③过滤C中的混合液.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(Ⅱ)用I2的标准溶液测定产品的纯度取5.5g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
(2)根据选择电解质溶液的不同,填写下表:
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
 ②
②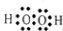 ③
③ ④
④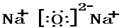 ⑤
⑤ ⑥
⑥ ⑦
⑦