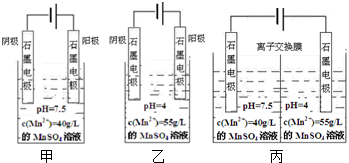
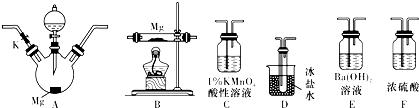
题目内容
19.某烧杯中盛有100mL FeCl3和CuCl2的混合液,混合溶液中c(FeCl3)=2mol/L,c(CuCl2)=1mol/L.请回答下列问题:(1)该混合溶液中,Fe3+的物质的量n(Fe3+)=0.2mol.氯离子的物质的量浓度c(Cl-)=8mol/L.
(2)向上述烧杯中加入足量铁粉并使之充分反应.写出有关的离子方程式:
①2Fe3++Fe═3Fe2+;
②Cu2++Fe═Cu+Fe2+.
分析 (1)根据n=cV计算出混合液中含有铁离子的物质的量;先计算出混合液中氯离子的物质的量,再根据c=$\frac{n}{V}$计算出含有中氯离子的浓度;
(2)加入铁粉后,铁离子与铁反应生成亚铁离子,然后铜离子与铁粉反应生成亚铁离子和铜离子,据此写出反应的离子方程式.
解答 解:(1)该混合溶液中,Fe3+的物质的量为:n(Fe3+)=cV=2mol/L×0.1L=0.2mol;
氯离子的物质的量等于FeCl3和CuCl2中氯离子物质的量的和,则n(Cl-)=3n(Fe3+)+2n(Cu2+)=0.2mol×3+1mol/L×2×0.1L=0.8mol,
混合溶液中氯离子的物质的量浓度c(Cl-)=$\frac{0.8mol}{0.1L}$=8mol/L,
故答案为:0.2mol;8;
(2)向上述烧杯中加入足量铁粉并使之充分反应,发生的反应有:①2Fe3++Fe═3Fe2+,②Cu2++Fe═Cu+Fe2+,
故答案为:2Fe3++Fe═3Fe2+;Cu2++Fe═Cu+Fe2+.
点评 本题考查了混合物反应的计算、离子方程式书写,题目难度中等,明确物质的量与物质的量浓度的关系为解答关键,注意掌握常见物质性质及发生反应原理,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
9.下列物质依次按照混合物、氧化物、电解质和非电解质的顺序排列的一组是( )
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
10.下列应用与盐类的水解无关的是( )
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
7.地质上常用放射性同位素${\;}_{6}^{14}$C进行“地质考古”,则下列说法中错误的是( )
| A. | ${\;}_{6}^{14}$C的中子数是8 | |
| B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同位素 | |
| C. | ${\;}_{6}^{14}$C转化为${\;}_{6}^{12}$C不是化学变化 | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
14.两种烃以任意比例混合,在105℃时1L混合烃与9L O2混合,充分燃烧后恢复至原状态,所得气体体积仍为10L.下列各组混合烃中符合此条件的是( )
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H6 | D. | C2H2、C3H6 |
4. 葡萄可用于酿酒.
葡萄可用于酿酒.
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是产生砖红色沉淀.
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的化学方程式C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH.
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备.实验室用如图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是CH3COOH+C2H5OH CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
②试管b中盛放的试剂是饱和Na2CO3溶液.
③实验开始时,试管b中的导管不伸入液面下的原因是防止溶液倒吸.
(4)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
④写出E与足量Na的化学方程式CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑
⑤写出E与NaHCO3溶液反应的化学方程式HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑.
 葡萄可用于酿酒.
葡萄可用于酿酒.(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是产生砖红色沉淀.
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的化学方程式C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH.
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备.实验室用如图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是CH3COOH+C2H5OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.②试管b中盛放的试剂是饱和Na2CO3溶液.
③实验开始时,试管b中的导管不伸入液面下的原因是防止溶液倒吸.
(4)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
| ①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为90: |
| ②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为0.3 mol, 生成的H2O5.4g. 有机物E的分子式C3H6O3 |
| ③经红外光谱测定,证实其中含有羟基,羧基,甲基; | ③E的结构简式CH3CH(OH)COOH |
⑤写出E与NaHCO3溶液反应的化学方程式HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑.
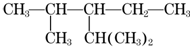 ,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.
,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.