题目内容
9.(1)根据氧化还原反应2H2+O2═2H2O,设计成燃料电池,负极通的气体应是H2,正极通的气体应是O2.(2)根据选择电解质溶液的不同,填写下表:
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
分析 (1)根据电池反应式可知在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应;
(2)酸性溶液,此时应考虑不可能有OH-生成,所以负极发生氧化反应,电极反应为H2-2e-=2H+,正极发生还原反应,电极反应为O2+4H++4e-=2H2O,生成水导致氢离子浓度减少,pH增大;H2应该在负极上反应,O2应该在正极上反应,又因为是碱性溶液,不可能有H+参加或生成,生成水导致氢氧根离子的浓度减小;
(3)如把H2改为甲烷,KOH溶液做电解质,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐.
解答 解:(1)根据电池反应式可知在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应,故答案为:H2;O2;
(2)酸性溶液,此时应考虑不可能有OH-生成,所以负极发生氧化反应,电极反应为H2-2e-=2H+,正极发生还原反应,电极反应为O2+4H++4e-=2H2O,生成水导致氢离子浓度减少,pH增大,所以H2SO4溶液:负极:H2-2e-=2H+;正极:O2+4H++4e-=2H2O;溶液的pH变化:增大;
H2应该在负极上反应,O2应该在正极上反应,正极的电极反应为O2+2H2O+4e-=4OH-;又因为是碱性溶液,不可能有H+参加或生成,故负极的电极反应为H2-2e-+2OH-=2H2O,生成水导致氢氧根离子的浓度减小,所以溶液的pH减小,所以KOH溶液:负极:H2-2e-+2OH-=2H2O;正极:O2+2H2O+4e-=4OH-;溶液的pH变化:减小,
故答案为:
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | H2-2e-=2H+ | H2-2e-+2OH-=2H2O |
| 正极反应式 | O2+4H++4e-=2H2O | O2+2H2O+4e-=4OH- |
| 溶液的pH变化 | 增大 | 减小 |
(3)如把H2改为甲烷,KOH溶液做电解质,氧气在正极得到电子生成氢氧根离子,则正极为2O2+4H2O+8e-=8OH-,甲烷失电子在碱溶液中反应,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐,此时不会有CO2放出;负极为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了原电池原理、组成、电极名称和电极反应的分析判断,注意不同电解质溶液中电极反应产物的书写,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
1.下列叙述中正确的是( )
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
18.下列关于离子的检验说法正确的是( )
| A. | 向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| B. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| C. | 向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的蓝色石蕊试纸靠近试管口,若试纸变红,则说明该溶液中有NH4+ | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
19. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到化学平衡的是BC;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
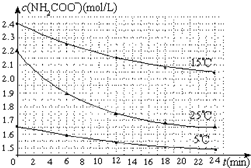
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
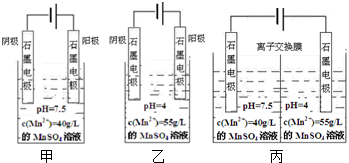
 图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
图是实验室制取SO2并验证SO2的某些性质的装置,试回答: