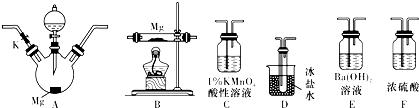
题目内容
20.下列化合物:①H2O、②H2O2、③Na0H、④Na2O、⑤Na2O2、⑥Cl2、⑦NaCl(1)写出上述物质的电子式
①
 ②
②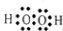 ③
③ ④
④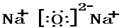 ⑤
⑤ ⑥
⑥ ⑦
⑦
(2)只含有离子键的是④⑦,只含有极性键的是①,只含有非极性键的是⑥,既有离子键又有极性键的是③既有离子键又有非极性键的是⑤,既有极性键又有非极性键的是②,属于共价化合物的是①②,属于离子化合物的是③④⑤⑦.
分析 (1)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
(2)一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,只含共价键的化合物为共价化合物,分子晶体熔化时不破坏化学键,而熔融状态时和固态时,都能导电为金属单质,以此来解答.
解答 解:(1)①H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,故答案为:
,故答案为: ;
;
②H2O2为共价化合物,电子式分别为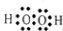 ,故答案为:
,故答案为: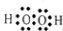 ;
;
③氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故答案为:
,故答案为: ;
;
④Na2O是钠离子和氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成阴离子,电子式为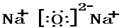 ,
,
故答案为: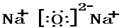 ;
;
⑤Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
⑥Cl2分子中存在1个氯氯共用电子对,氯气分子的电子式为 ,故答案为:
,故答案为: ;
;
⑦NaCl为离子化合物,由钠离子与氯离子构成,电子式为: ,故答案为:
,故答案为: ;
;
(2)①H2O只含-OH极性共价键,为共价化合物;②H2O2中含O-H极性键和O-O非极性键,为共价化合物;③Na0H中含离子键和O-H极性共价键,为离子化合物;④Na2O只含离子键,为离子化合物;⑤Na2O2中含离子键和O-O非极性键,为离子键;⑥Cl2只含Cl-Cl非极性键,为单质;⑦NaCl中只含离子键,为离子化合物,则
只含有离子键的是④⑦,只含有极性键的是①,只含有非极性键的是⑥,既有离子键又有极性键的是③,既有离子键又有非极性键的是⑤,既有极性键又有非极性键的是②,属于共价化合物的是①②,属于离子化合物的是③④⑤⑦,
故答案为:④⑦;①;⑥;③;⑤;②;①②;③④⑤⑦.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注意电子式的书写及物质中的化学键判断,题目难度不大.

| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
| A. | 有机物在滤液中 | B. | 杂质在滤液中 | C. | 有机物滤纸上 | D. | 杂质在溶剂中 |
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
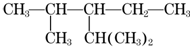 ,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.
,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.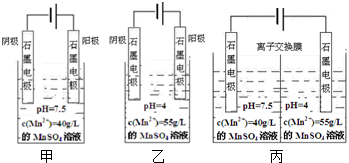

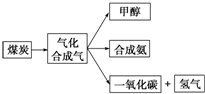 (1)如图是某煤化工产业链的一部分:
(1)如图是某煤化工产业链的一部分: