题目内容
10.对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.(1)现有下列6种物质:SO2,SiO2,CaO,MgO,Fe2O3,Na2O2按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①SO2常温常压下是气体,其余是固体;
②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物.
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol/L的FeCl3溶液,可制得一种红褐色胶体.
①反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
②如何用较简单的方法判断胶体是否制备成功?若该分散系能产生丁达尔效应,则制备成功;否则,不成功.
分析 (1)都为氧化物,其中SO2为气体,Na2O2中O元素的化合价为-1价,其它氧化物为-2价;
(2)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;胶体有丁达尔效应:用一束光线照射,能产生一条光亮的通路;氢氧化铁胶体遇电解质溶液发生聚沉后会产生氢氧化铁沉淀.
解答 解:(1)都为氧化物,其中SO2为气体,其它为固态,Na2O2中O元素的化合价为-1价,其它氧化物为-2价,
故答案为:SO2常温常压下是气体,其余是固体;Na2O2是过氧化物,氧元素呈-1价,其余物质中的氧元素呈-2价;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,
故答案为:若该分散系能产生丁达尔效应,则制备成功,否则,不成功.
点评 本题考查较为综合,涉及物质的分类、胶体的性质,侧重于基本概念的理解和掌握的考查,难度不大.

练习册系列答案
相关题目
1.下列叙述中正确的是( )
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
18.下列关于离子的检验说法正确的是( )
| A. | 向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| B. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| C. | 向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的蓝色石蕊试纸靠近试管口,若试纸变红,则说明该溶液中有NH4+ | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
2.等质量的 SO2 和 SO3 相比较,下列结论正确的是( )
| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
19. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到化学平衡的是BC;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
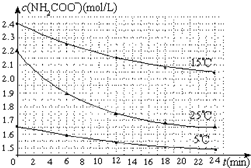
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
20.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).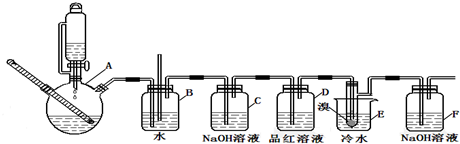
有关数据列表如下:
请完成下列填空:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)请写出C装置中的作用除去乙烯中混有的酸性气体杂质.
(3)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈.
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行是(填“是”或“否”),其原因是乙烯和液溴均易溶于四氯化碳.
(6)制取的1,2-二溴乙烷可以进一步反应生成一种有机物,汽车常用该有机物作为防冻液.写出由1,2-二溴乙烷制取该有机物的反应方程式:BrCH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,反应类型水解反应或取代反应.

有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm2 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)请写出C装置中的作用除去乙烯中混有的酸性气体杂质.
(3)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈.
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行是(填“是”或“否”),其原因是乙烯和液溴均易溶于四氯化碳.
(6)制取的1,2-二溴乙烷可以进一步反应生成一种有机物,汽车常用该有机物作为防冻液.写出由1,2-二溴乙烷制取该有机物的反应方程式:BrCH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,反应类型水解反应或取代反应.