题目内容
某温度时,在2L恒容密闭容器甲中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)体系中发生反应的化学方程式是 ;
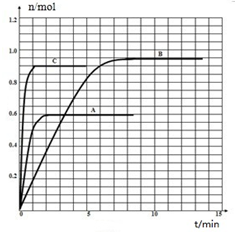
(2)如果该反应是放热反应.改变实验条件得到Z的物质的量随时间变化的曲线A、B、C(如图所示)则曲线A、B、C所对应的实验条件改变分别是:A B C
(3)若容器甲达平衡时放出热量为Q KJ.相同条件下向2L恒容密闭容器乙中通入2.00mol X和2.00mol Y,反应达到新的平衡时放出的热量 2Q kJ(填大于、小于或等于).
(4)在相同温度下,在2L恒压密闭容器丙中通入1.00mol X和1.00mol Y,反应达到新的平衡时生成Z的物质的量 0.90mol(填大于、小于或等于).
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(2)如果该反应是放热反应.改变实验条件得到Z的物质的量随时间变化的曲线A、B、C(如图所示)则曲线A、B、C所对应的实验条件改变分别是:A

(3)若容器甲达平衡时放出热量为Q KJ.相同条件下向2L恒容密闭容器乙中通入2.00mol X和2.00mol Y,反应达到新的平衡时放出的热量
(4)在相同温度下,在2L恒压密闭容器丙中通入1.00mol X和1.00mol Y,反应达到新的平衡时生成Z的物质的量
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据物质的量的变化与化学计量数呈正比书写化学方程式;
(2)根据改变条件对化学平衡移动的影响判断;
(3)根据压强对化学平衡的影响判断;
(4)正反应方向为气体体积减小的方向,则恒压条件比恒容条件下,体系压强大,据此判断.
(2)根据改变条件对化学平衡移动的影响判断;
(3)根据压强对化学平衡的影响判断;
(4)正反应方向为气体体积减小的方向,则恒压条件比恒容条件下,体系压强大,据此判断.
解答:
解:(1)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,
故答案为:X+2Y?2Z;
(2)A曲线达到平衡时,时间缩短,且Z物质的量减小,即改变条件后,化学平衡向逆反应方向移动且加快了反应速率,可想到条件改变为:升高温度;曲线B达平衡时,时间缩短,且Z物质的量增大,即改变条件后,化学平衡向正反应方向移动且加快了反应速率,可想到条件改变为:增大压强或增加反应物浓度;曲线C,加快了反应速率,Z的物质的量不变,可想到条件变化为:加催化剂,故答案为:温度升高;加压或增加反应物浓度;加催化剂;
(3)反应物气体体积大于生成物体积,反应物浓度增大1倍,化学平衡进行程度增大,放出热量大于原平衡放出热量的2倍,故答案为:大于;
(4)正反应方向为气体体积减小的方向,则恒压条件比恒容条件下,体系压强大,故达平衡时Z物质的量比原平衡大,故答案为:大于.
故答案为:X+2Y?2Z;
(2)A曲线达到平衡时,时间缩短,且Z物质的量减小,即改变条件后,化学平衡向逆反应方向移动且加快了反应速率,可想到条件改变为:升高温度;曲线B达平衡时,时间缩短,且Z物质的量增大,即改变条件后,化学平衡向正反应方向移动且加快了反应速率,可想到条件改变为:增大压强或增加反应物浓度;曲线C,加快了反应速率,Z的物质的量不变,可想到条件变化为:加催化剂,故答案为:温度升高;加压或增加反应物浓度;加催化剂;
(3)反应物气体体积大于生成物体积,反应物浓度增大1倍,化学平衡进行程度增大,放出热量大于原平衡放出热量的2倍,故答案为:大于;
(4)正反应方向为气体体积减小的方向,则恒压条件比恒容条件下,体系压强大,故达平衡时Z物质的量比原平衡大,故答案为:大于.
点评:本题考查化学反应速率的影响因素的定量判断,题目难度中等,注意分析曲线的变化特点.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
230Th和232Th是钍的两种同位素,232Th可以转化成
U.下列有关Th、U的说法正确的是( )
233 92 |
A、铀(U)是92号元素,
| ||
| B、Th元素的相对原子质量是231 | ||
| C、232Th转换成233U是化学变化 | ||
| D、230Th和232Th的性质不同 |
下列说法正确的是( )
| A、吸热反应一定要加热才能发生 |
| B、在5mL 0.1mol?L-1的KI溶液中加入5滴0.1mol?L-1 FeCl3溶液,充分震荡后,取少量混合液液加入几滴KSCN溶液,溶液显红色 |
| C、一定温度下,在某容器中进行可逆反应:C(s)+H2O(g)?CO(g)+H2(g),只要增大压强,反应速率一定加快 |
| D、电解氯化钠溶液可制得金属钠 |
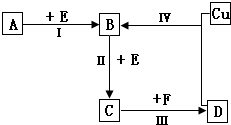 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题: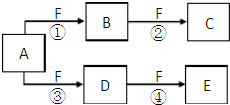 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.