题目内容
1.下列各选项中所述的两个量,前者一定大于后者的是( )| A. | pH=10的NaOH和CH3COONa溶液中,水的电离程度 | |
| B. | 25℃与80℃纯水的pH | |
| C. | 将pH=3的醋酸和盐酸分别稀释100倍后溶液的pH | |
| D. | 相同温度下,10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 |
分析 A.强碱抑制水的电离,存在弱根的盐促进水的电离;
B.水的电离为吸热过程,升高温度,促进水的电离,氢离子浓度和氢氧根浓度均增大,pH减小;
C.醋酸为弱酸,稀释过程促进其电离;
D.n=cV,浓度越大,弱酸的电离程度越小.
解答 解:A.氢氧化钠溶液中水的电离受到抑制,醋酸钠中水的电离受到促进,后者大于前者,故A错误;
B.升高温度,水的电离程度增大,pH减小,前者pH大于后者,故B正确;
C.醋酸与盐酸均稀释100倍,盐酸的pH变为5,醋酸pH小于5,后者大于前者,故C错误;
D.同等温度下,10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中醋酸的物质的量相同,但是稀溶液中醋酸的电离程度增大,故氢离子浓度前者小于后者,故D错误,故选B.
点评 本题主要考查的是溶液中离子浓度大小比较,涉及盐类的水解、溶液的稀释、弱电解质的电离等,综合性较强,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列各组有机物中,其一氯代物的数目不相等的是( )
(1)正戊烷和正己烷
(2)苯和乙烷
(3)对二甲苯和2,2-二甲基丙烷
(4)甲苯和2-甲基丙烷.
(1)正戊烷和正己烷
(2)苯和乙烷
(3)对二甲苯和2,2-二甲基丙烷
(4)甲苯和2-甲基丙烷.
| A. | (2)(4) | B. | (3)(4) | C. | (1)(3) | D. | (1)(2) |
12.下列叙述正确的是( )
| A. | 氯水久置后pH增大 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 可用澄清石灰水除去CO2中混有的少量SO2 |
9.下列化学药品的贮存和使用正确的是( )
| A. | 少量白磷贮存于水中,切割时要在水下进行 | |
| B. | 液溴直接保存于磨口玻璃塞的细口棕色瓶中 | |
| C. | KOH溶液存放在磨口玻璃塞的广口瓶中 | |
| D. | 少量金属钠存放在无水乙醇中 |
16.下列说法正确的是( )
| A. | 乙烯和聚乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 等质量的乙烯与聚乙烯完全燃烧,产生的CO2质量相等 | |
| C. | 乙醇和乙醚(CH3CH2OCH2CH3)互为同分异构体 | |
| D. | 乙炔与苯互为同系物 |
6.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,18 g水中含有的水分子数目为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
8.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2 H2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴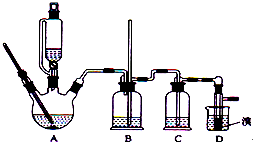 和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
回答下列问题:
(1)在发生反应前,分液漏斗使用前必须要检漏;在反应中,要加入沸石的作用是防暴沸,若加热后发现未加沸石,应采取的正确方法是:冷却后补加
(2)在装置B中安全管的作用原理是:当B压力过大时,安全管中液面上升,使B瓶中压力稳定
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应从下 口出(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用d洗涤除去;(填正确选项前的字母)
a.水 b.乙醇 c.碘化钠溶液 d.氢氧化钠溶液
发生的反应方程式为:2NaOH+Br2═NaBr+NaBrO+H2O
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发.
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴
 和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在发生反应前,分液漏斗使用前必须要检漏;在反应中,要加入沸石的作用是防暴沸,若加热后发现未加沸石,应采取的正确方法是:冷却后补加
(2)在装置B中安全管的作用原理是:当B压力过大时,安全管中液面上升,使B瓶中压力稳定
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应从下 口出(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用d洗涤除去;(填正确选项前的字母)
a.水 b.乙醇 c.碘化钠溶液 d.氢氧化钠溶液
发生的反应方程式为:2NaOH+Br2═NaBr+NaBrO+H2O
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发.

 $\stackrel{KOH}{→}$H-C≡
$\stackrel{KOH}{→}$H-C≡
 +H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团)
+H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团) ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.