题目内容
9.下列化学药品的贮存和使用正确的是( )| A. | 少量白磷贮存于水中,切割时要在水下进行 | |
| B. | 液溴直接保存于磨口玻璃塞的细口棕色瓶中 | |
| C. | KOH溶液存放在磨口玻璃塞的广口瓶中 | |
| D. | 少量金属钠存放在无水乙醇中 |
分析 A.白磷熔点低,和水不反应;
B.液溴易挥发,需要用水封保存;
C.氢氧化钾溶液会与玻璃塞中的二氧化硅反应;
D.钠能够与乙醇发生反应.
解答 解:A.白磷熔点为40℃且和水不反应,其密度大于水,所以少量的白磷贮存在水中,切割时在水下进行,故A正确;
B.溴易挥发,需要水封保存,且应保存在磨口玻璃塞棕色细口试剂瓶中,故B错误;
C.氢氧化钾与玻璃中的二氧化硅反应生成具有黏性的硅酸钠,易导致玻璃塞打不开,应该使用橡胶塞,故C错误;
D.钠与乙醇发生反应,不能保存在乙醇中,可保存在煤油中,故D错误;
故选B.
点评 本题考查药品的保存,题目难度不大,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握相关物质的性质,注意相关基础知识的积累.

练习册系列答案
相关题目
19.乙酸与乙酸乙酯的混合物中H元素的质量分数是$\frac{1}{11}$,则O元素的质量分数是( )
| A. | $\frac{10}{11}$ | B. | $\frac{7}{11}$ | C. | $\frac{6}{11}$ | D. | $\frac{4}{11}$ |
20.下列关于粒子结构的描述不正确的是( )
| A. | H2S和NH3价电子总数均是8 | |
| B. | 次氯酸分子的结构式为:H-Cl-O | |
| C. | HS-和HCl均是含一个极性键的18电子粒子 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
14.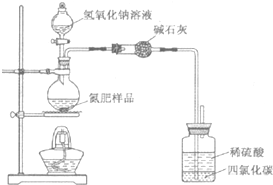 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
1.下列各选项中所述的两个量,前者一定大于后者的是( )
| A. | pH=10的NaOH和CH3COONa溶液中,水的电离程度 | |
| B. | 25℃与80℃纯水的pH | |
| C. | 将pH=3的醋酸和盐酸分别稀释100倍后溶液的pH | |
| D. | 相同温度下,10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 |
18.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 乙烯的最简式为CH3 |
17.已知一种0.1mol•L-1的一元酸和一种0.1mol•L-1的一元碱溶液等体积混合后,溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等pH值的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: