题目内容
6.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,18 g水中含有的水分子数目为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
分析 A.质量转化为物质的量;
B.1mol碳酸钠中含有2mol钠离子;
C.通常状况下Vm≠22.4L/mol;
D.溶液体积未知.
解答 解:A.常温常压下,18 g水中含有的水分子数目:$\frac{18g}{18g/mol}$×NA=NA,故A正确;
B.常温常压下,1.06g Na2CO3含有的Na+离子数:$\frac{1.06g}{106g/mol}$×2×NA=0.02NA,故B正确;
C.通常状况下Vm≠22.4L/mol,无法计算气体的体积,故C错误;
D.溶液体积未知,无法计算微粒的个数,故D错误;
故选:AB.
点评 本题考查了阿伏伽德罗常数的应用,把握以物质的量为中心的有关计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
14.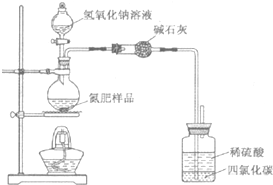 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
1.下列各选项中所述的两个量,前者一定大于后者的是( )
| A. | pH=10的NaOH和CH3COONa溶液中,水的电离程度 | |
| B. | 25℃与80℃纯水的pH | |
| C. | 将pH=3的醋酸和盐酸分别稀释100倍后溶液的pH | |
| D. | 相同温度下,10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 |
18.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 乙烯的最简式为CH3 |
13.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O
相关物质的部分物理性质如表格:
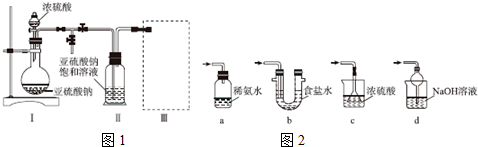
实验流程如图1:

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)本实验中下列药品不能代替氢氧化铜使用的是D
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
(一)制备苯甲酸乙酯
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如表格:
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)本实验中下列药品不能代替氢氧化铜使用的是D
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
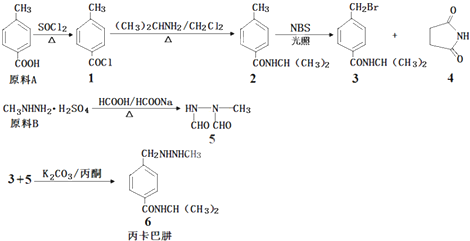
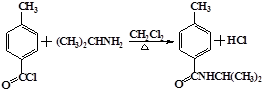 .
. .
. .
.