题目内容
15.已知反应A2+B2═2AB,破坏1mol A2中的化学键消耗的能量为Q1 kJ,破坏1mol B2中的化学键消耗的能量为Q2 kJ,形成1mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )| A. | 若A2和B2的总能量大于生成的AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2>Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2>Q3 |
分析 反应吸热放热可以利用能量守恒分析判断,也可以依据物质化学键的键能分析判断,反应焓变△H=反应物断键吸收的热量-生成物形成化学键放出的热量.
解答 解:A、依据能量守恒,若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热,故A正确;
B、依据能量守恒,若A2和B2的总能量之和小于生成的2AB的总能量,则反应吸热,故B错误;
C、若该反应为放热反应,依据反应焓变△H=反应物断键吸收的热量-生成物形成化学键放出的热量,则Q1+Q2<2Q3,故C错误;
D、若该反应为吸热反应,则Q1+Q2>2Q3,故D错误.
故选A.
点评 本题考查了反应能量变化判断,能量守恒,化学键键能大小的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
5.已知断开1molH-H键吸收的能量为436KJ,形成1molH-H键放出的能量为391KJ,根据化学方程式N2+3H2$?_{高温,高压}^{催化剂}$2NH3,反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
6.已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
无水乙醇性质如表:
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).

实验操作和现象:
(1)写出乙烯的1个用途:制塑料,对应方程式为(注明反应类型) ,加聚反应.
,加聚反应.
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
请回答下列问题:
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
无水乙醇性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
 ,加聚反应.
,加聚反应.(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
10.苯加溴水后,振荡,溴水层颜色变浅,这是由于( )
| A. | 溴挥发了 | B. | 发生了取代反应 | ||
| C. | 苯萃取了溴水中的溴 | D. | 发生了加成反应 |
 .
.
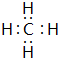 ;
;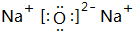 ;
;

 .
. ,
, $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.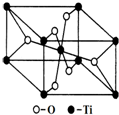 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: