题目内容
现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化成Mg(OH)2,并使Mg2+、Al3+分离开来,4mol/L NaOH溶液的最少用量为( )
| A、140mL | B、120mL |
| C、100mL | D、80mL |
考点:有关混合物反应的计算
专题:计算题
分析:根据溶液呈电中性可知:2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,根据n(Mg2+)=0.2mol/L×0.2L=0.04mol,可知铝离子的物质的量为:n(Al3+)=0.06mol,欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,结合离子方程式计算出消耗氢氧根离子的物质的量,再根据V=
计算出至少消耗氢氧化钠溶液的体积.
| n |
| c |
解答:
解:根据溶液为电中性可知:2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,
溶液中镁离子的物质的量为:n(Mg2+)=0.2mol/L×0.2L=0.04mol,
则:n(Al3+)=
[n(Cl-)-2n(Mg2+)]=0.06mol,
要将Mg2+全部沉淀分离出来,可需要发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,
则至少需要消耗氢氧化钠的物质的量为:n(NaOH)=2n(Mg2+)+4n(Al3+)=0.04mol×2+0.06mol×4=0.32mol,
所以至少需要该氢氧化钠溶液的体积为:V(NaOH)=
=0.08L=80mL,
故选D.
溶液中镁离子的物质的量为:n(Mg2+)=0.2mol/L×0.2L=0.04mol,
则:n(Al3+)=
| 1 |
| 3 |
要将Mg2+全部沉淀分离出来,可需要发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,
则至少需要消耗氢氧化钠的物质的量为:n(NaOH)=2n(Mg2+)+4n(Al3+)=0.04mol×2+0.06mol×4=0.32mol,
所以至少需要该氢氧化钠溶液的体积为:V(NaOH)=
| 0.32mol |
| 4mol/L |
故选D.
点评:本题考查离子方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,题目难度中等,根据溶液电中性计算铝离子的物质的量为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、物质发生化学反应都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个化学反应中,反应物的总能量与生成物的总能量一定相同 |
| D、在一个化学反应中,反应物的总能量一定高于生成物的总能量 |
只用一种试剂,区别甲苯,四氯化碳,己烯,乙醇,碘化钾溶液,亚硫酸6种无色溶液,应选用( )
| A、酸性KMnO4溶液 |
| B、溴水 |
| C、碘水 |
| D、硝酸银溶液 |
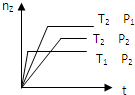 反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、△H>0,X为气体 |
| B、△H>0,X为固体 |
| C、△H<0,X为气体 |
| D、△H<0,X为固体 |