题目内容
质量分数相等的Na2CO3和NaHCO3混合物xg,加热一段时间后质量变为yg,当y为何值时,表明NaHCO3完全分解( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:化学方程式的有关计算
专题:计算题
分析:由质量分数计算混合物中Na2CO3和NaHCO3的质量,加热发生反应:2NaHCO3
Na2CO3+H2O+CO2↑,据此计算反应生成碳酸钠的质量,进而计算最终碳酸钠的总质量.
| ||
解答:
解:碳酸钠和碳酸氢钠的质量分数相同,所以两者的质量都是0.5x g,碳酸氢钠受热会发生分解,最后固体质量碳酸钠,
设碳酸氢钠全部分解后生成碳酸钠的质量为Z,则:
2NaHCO3
Na2CO3+H2O+CO2↑
168 106
0.5xg z
则z=
=
g
所以剩余固体质量为:0.5x+
g=
g,
故选B.
设碳酸氢钠全部分解后生成碳酸钠的质量为Z,则:
2NaHCO3
| ||
168 106
0.5xg z
则z=
| 106×0.5xg |
| 168 |
| 53x |
| 168 |
所以剩余固体质量为:0.5x+
| 53x |
| 168 |
| 137x |
| 168 |
故选B.
点评:本题考查化学方程式有关计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
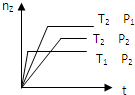 反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、△H>0,X为气体 |
| B、△H>0,X为固体 |
| C、△H<0,X为气体 |
| D、△H<0,X为固体 |
 在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的
在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的| 1 |
| 4 |
| A、3:4 | B、1:1 |
| C、2:1 | D、7:2 |
向某稀硝酸溶液中加入5.6g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加3.4g,则所得溶液中Fe2+、Fe3+的物质的量浓度之比为( )
| A、1:1 | B、2:1 |
| C、3:2 | D、4:1 |
全轨电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)
VO2+(黄色)+V2+(绿色)+2H+下列说法错误的是( )
| 充电 |
| 放电 |
| A、充电时,阳极附近溶液由蓝色逐渐变为黄色 |
| B、放电过程中,正极附近溶液的酸性减弱 |
| C、充电时,反应每生成2mol H+时电子转移数为2mol |
| D、放电时,正极反应为VO2++2H++e-═VO2++H2O |
用下列装置能实现相应实验目的是( )
A、 石油的蒸馏 |
B、 用大理石和稀盐酸制备CO2 |
C、 滴定管读数 |
D、 醋化反应 |