题目内容
向200mL1.5mol?L-1的硫酸溶液中加入一定量Fe2O3、Cu的混合物,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,剩余固体的质量为( )
| A、17.6g | B、22.4g |
| C、2.4g | D、4.8g |
考点:有关混合物反应的计算
专题:计算题
分析:Cu、Fe2O3的混合物中加入硫酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4;根据反应2Fe3++Cu=2Fe2++Cu2+可知,硫酸亚铁与硫酸铜的物质的量之比为2:1,根据n=cV计算出硫酸的物质的量,再根据质量守恒计算出硫酸铜、硫酸亚铁的物质的量;最后得到的金属为铁、铜的质量,根据质量守恒可以计算出用CO含有后剩余金属的质量.
解答:
解:Cu、Fe2O3的混合物中加入硫酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4,根据反应2Fe3++Cu=2Fe2++Cu2+可知,硫酸亚铁与硫酸铜的物质的量之比为2:1,
200mL1.5mol?L-1的硫酸溶液中含有硫酸的物质的量为:1.5mol/L×0.2L=0.3mol,
根据硫酸根离子守恒,则生成的硫酸铜的物质的量为:n(CuSO4)=0.3mol×
=0.1mol,n(FeSO4)=0.3mol-0.1mol=0.2mol,
最后剩余金属的质量为Fe、Cu的质量,根据质量守恒,m(Fe)+m(Cu)=56g/mol×0.2mol+64g/mol×0.1mol=17.6g,
故选A.
200mL1.5mol?L-1的硫酸溶液中含有硫酸的物质的量为:1.5mol/L×0.2L=0.3mol,
根据硫酸根离子守恒,则生成的硫酸铜的物质的量为:n(CuSO4)=0.3mol×
| 1 |
| 3 |
最后剩余金属的质量为Fe、Cu的质量,根据质量守恒,m(Fe)+m(Cu)=56g/mol×0.2mol+64g/mol×0.1mol=17.6g,
故选A.
点评:本题考查了混合物反应的计算,题目难度中等,注意掌握有关混合物反应的计算方法,明确反应原理为解答本题的关键,注意质量守恒定律在化学计算中的应用方法.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是( )
| A、氯碱工业中,电解槽的阳极区产生NaOH |
| B、氯气和氢气混合在光照条件下反应生成氯化氢,用水吸收得到盐酸 |
| C、合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高 |
| D、二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
只用一种试剂,区别甲苯,四氯化碳,己烯,乙醇,碘化钾溶液,亚硫酸6种无色溶液,应选用( )
| A、酸性KMnO4溶液 |
| B、溴水 |
| C、碘水 |
| D、硝酸银溶液 |
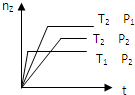 反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、△H>0,X为气体 |
| B、△H>0,X为固体 |
| C、△H<0,X为气体 |
| D、△H<0,X为固体 |
 在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的
在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的| 1 |
| 4 |
| A、3:4 | B、1:1 |
| C、2:1 | D、7:2 |
用下列装置能实现相应实验目的是( )
A、 石油的蒸馏 |
B、 用大理石和稀盐酸制备CO2 |
C、 滴定管读数 |
D、 醋化反应 |