题目内容
5.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Y2+与X3-具有相同的电子层结构,X与Y、Z位于相邻的周期.下列说法正确的是( )| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
分析 短周期元素X、Y、Z的原子序数依次递增,Y2+与X3-具有相同的电子层结构,则Y为Mg元素,X为N元素;X与Y、Z位于相邻周期,其原子的最外层电子数之和为13,则Z的最外层电子数=13-5-2=6,所以Z为S元素,据此解答.
解答 解:短周期元素X、Y、Z的原子序数依次递增,Y2+与X3-具有相同的电子层结构,则Y为Mg元素,X为N元素;X与Y、Z位于相邻周期,其原子的最外层电子数之和为13,则Z的最外层电子数=13-5-2=6,所以Z为S元素,
A.N的最高价氧化物对应的水化物为硝酸,属于强酸,故A错误;
B.Z为S元素,位于元素周期表的第3周期ⅥA族,故B正确;
C.Y为Mg,氢氧化镁与NaOH不反应,故C错误;
D.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径r(Mg)>r(S)>r(N),故D错误,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握核外电子排布,侧重考查分析、推断能力,题目难度不大.

练习册系列答案
相关题目
16.键线式可以简明扼要的表示碳氢化合物的结构,键线式为  的物质名称是( )
的物质名称是( )
 的物质名称是( )
的物质名称是( )| A. | 丙烯 | B. | 2-丁烯 | C. | 1-丁烯 | D. | 丁烷 |
20.下列物质中属于有机物的是( )
| A. | 碳酸 | B. | 二氧化碳 | C. | 碳酸钠 | D. | 甲烷 |
10.用于配制一定物质的量浓度的溶液的实验装置是( )
| A. |  | B. |  | C. |  | D. |  |
17.下列反应中,生成的有机物只有一种的是( )
| A. | 异戊二烯(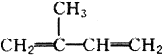 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(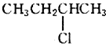 )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 新戊烷和氯气发生取代反应生成一氯取代物的反应 |
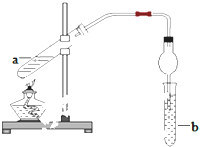 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O. .
.