题目内容
用NA代表阿伏加德罗常数,相关说法不正确的是( )
| A、13.5 g Al与足量盐酸反应生成H2的分子数为NA |
| B、标准状况下,2.24 L CH4所含电子数为NA |
| C、500 mL 1 mol?L-1的K2SO4溶液中含有K+数目为NA |
| D、0.5 mol O2和0.5 mol O3的混合物所含有的氧原子个数为2.5NA |
考点:阿伏加德罗常数
专题:
分析:A、依据n=
计算物质的量,结合铝和盐酸反应生成氯化铝和氢气计算;
B、依据n=
计算物质的量,结合分子式计算电子数;
C、根据n=cV计算钾离子的物质的量,再根据N=nNA计算钾离子的数目;
D、根据氧气和臭氧的物质的量计算出氧原子的物质的量.
| m |
| M |
B、依据n=
| V |
| Vm |
C、根据n=cV计算钾离子的物质的量,再根据N=nNA计算钾离子的数目;
D、根据氧气和臭氧的物质的量计算出氧原子的物质的量.
解答:
解:A、依据n=
计算物质的量=
=0.5mol,结合铝和盐酸反应生成氯化铝和氢气的定量关系计算,2Al~3H2,生成H2的分子数为0.75NA,故A错误;
B、依据n=
计算物质的量=
=0.1mol,结合甲烷分子是10电子分子计算,0.1mol甲烷含电子数为NA,故A正确;
C、0.5L溶液中含有K+离子数为0.5L×1mol/L×2×NAmol-1=NA,故C正确;
D、0.5molO2含有1mol氧原子,0.5 mol O3含1.5mol氧原子,故0.5 mol O2和0.5 mol O3含有的氧原子的物质的量为2.5mol,个数为2.5NA,故D正确.
故选A.
| m |
| M |
| 13.5g |
| 27g/mol |
B、依据n=
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
C、0.5L溶液中含有K+离子数为0.5L×1mol/L×2×NAmol-1=NA,故C正确;
D、0.5molO2含有1mol氧原子,0.5 mol O3含1.5mol氧原子,故0.5 mol O2和0.5 mol O3含有的氧原子的物质的量为2.5mol,个数为2.5NA,故D正确.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4 |
| B、1mol/LCH3COOH与1mol/L CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA |
| C、常温常压下,3.6g H2O中含有电子数为2NA |
| D、含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g |
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4═FeSO4+H2↑ | ||||
B、CO+CuO
| ||||
C、Cu2(OH)2CO3
| ||||
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”,下列有关说法中正确的是(( )
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
欲配制下列四种无色透明的酸性溶液,其中能配制成功的是( )
| A、NH4+、NO3-、Al3+、Cl- |
| B、Na+、CH3COO-、K+、NO3- |
| C、MnO4-、K+、SO42-、Na+ |
| D、Ca2+、Mg2+、HCO3-、CO32- |
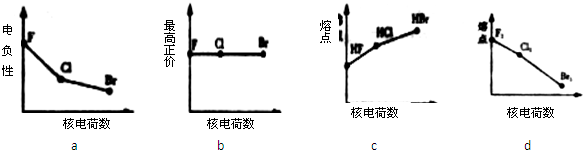
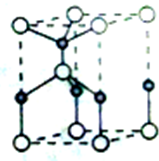 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为