题目内容
10.金属的表面处理可以使金属制品美观耐用,我国2000多年前就已经掌握化学镀铬即铬盐氧化处理技术,现代工业中常采用电镀或化学镀进行金属表面处理.请回答:(1)化学镀金是借助合适的还原剂,使镀液中金属离子还原沉积到金属表面.如化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,其离子方程式为Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+;
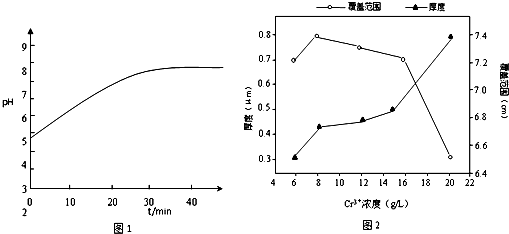
(2)工业上进行电镀时,待镀金属作为阴极.电镀铬若采用Cr3+的简单水溶液,电镀过程中阴极附近的pH与电镀时间的关系如图1,pH变化的原因是H+参与放电,上述过程的发生对镀层产生的影响是镀层变薄且不均匀;
(3)为防止上述过程发生,电镀铬可以在硫酸盐溶液体系中进行,图2为硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响,随厚度增加,镀层覆盖范围变化的原因可能是Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小;
(4)综合考虑镀层厚度及覆盖范围,电镀铬时温度以30~40℃为佳,工业上控制反应温度的设备名称为热交换器;电镀铬的过程中阳极会产生部分Cr2O72-,可以加入AB(填字母)除去;
A.H2O2 B.Na2SO3 C.FeSO4
(5)工业采用含Cr3+为3.25g/L的电解液电镀铬,则溶液pH不能大于4.(已知:35℃时,Kw=2.0×10-14,Ksp[Cr(OH)3]=5.0×10-31)
分析 (1)化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,还原产物是Ni,据此书写离子反应;
(2)在电镀工业中,待镀金属做阴极,镀层金属做阳极,根据电镀池中电极反应式来回答;
(3)根据硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响关系来分析原因;
(4)工业上控制反应温度的设备名称为热交换器,Cr2O72-具有很强的氧化性,可以和还原性的试剂之间发生反应,但是不能引进杂质离子;
(5)根据Ksp[Cr(OH)3]=5.0×10-31=c(Cr3+)•c3(OH-)来计算氢氧根离子浓度,根据Kw=c(H+)•c(OH-)来计算氢离子浓度,进而计算pH.
解答 解:(1)根据信息:化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,还原产物是Ni,结合氧化还原反应知识,得到反应为:Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+,故答案为:Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+;
(2)在电镀工业中,待镀金属做阴极,镀层金属做阳极,根据电镀过程中阴极附近的pH与电镀时间的关系图,可以看出由于H+参与放电,导致溶液pH的变化,在阴极上,应该是金属阳离子得电子析出金属单质的过程,由于氢离子参与放电,所以镀层变薄且不均匀,故答案为:阴;H+参与放电;镀层变薄且不均匀;
(3)根据硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响关系,得到:Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小,故答案为:Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小;
(4)工业上控制反应温度的设备名称为热交换器;镀铬的过程中阳极会产生部分Cr2O72-,Cr2O72+具有很强的氧化性,可以和还原性双氧水、亚硫酸钠之间发生反应,但是C选项的硫酸亚铁会引进杂质离子,故选AB,故答案为:热交换器;AB;
(5)含Cr3+为3.25g/L的电解液中,Cr3+的浓度是$\frac{\frac{3.25g}{52g/mol}}{1L}$=0.0625mol/L,根据Ksp[Cr(OH)3]=5.0×10-31=c(Cr3+)•c3(OH-),得到氢氧根离子浓度=$\root{3}{\frac{5.0×1{0}^{-31}}{0.0625}}$=2×10-10mol/L,Kw=c(H+)•c(OH-),c(H+)=$\frac{2×1{0}^{-14}}{2×1{0}^{-10}}$mol/L=10-4mol/L,所以pH=4,故答案为:4.
点评 本题涉及电解池的工作原理以及应用、难溶物的沉淀溶解平衡常数的计算等方面的知识,属于综合知识的考查,难度中等.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | CH3-CH═CH2与C2H4 | B. | CH3COOCH3与CH3CH2COOCH3 | ||
| C. | 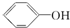 与 与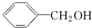 | D. | CH3CH2Cl与CH3CHClCH3 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | ① | ② | ③ | ④ | |||
| 第三周期 | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第四周期 | ⑨ | ⑩ |
(2)元素①的最高价氧化物的电子式
 ,元素③和⑤形成原子个数比为1:1的化合物的电子式
,元素③和⑤形成原子个数比为1:1的化合物的电子式 ,元素②、④的气态氢化物反应后的产物的电子式
,元素②、④的气态氢化物反应后的产物的电子式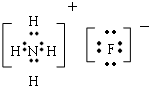 .
.(3)用电子式表示元素④和⑨形成化合物的过程
 .
.(4)元素③、④、⑥、⑦对应的气态氢化物中,稳定性最弱的是PH3(填化学式)
(5)元素④、⑤、⑦、⑨形成的简单离子中,半径最大的离子的离子结构示意图
 ;
;(6)元素⑥、⑦、⑩对应的最高价氧化物的水化物中,酸性最强的是H2SO4(填化学式),250mL 1mol/L的该溶液与足量的稀氨水反应放出的热量为Q1kJ,该反应的热化学方程式为:H2SO4(aq)+2NH3•H2O(aq)=(NH4)2SO4(aq)+2H2O(l)△H=-4Q1kJ/mol,元素⑤、⑧的最高价氧化物的水化物的稀溶液反应生成1mol水时放出Q2kJ的热量,则NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H=(Q2-2Q1)kJ/mol.
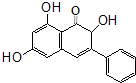 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |
| A. | 1mol乙基中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
| A. | 滴入的稀硫酸太少 | |
| B. | 不可能产生砖红色沉淀,因为水浴加热后未用碱液调节溶液的PH至碱性 | |
| C. | 蔗糖水解的最终产物不仅有葡萄糖,而且有果糖 | |
| D. | 产生的黑色物质可能是Cu(OH)2受热分解的产物CuO |
| A. | Na+、Al3+、OH- | B. | Ba2+、NO3-、SO42- | C. | K+、Na+、NO3- | D. | K+、NH4+、OH- |



 .W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种):
.W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种): 、
、
 为原料制取液晶材料的中间体
为原料制取液晶材料的中间体  的合成路线图.
的合成路线图.