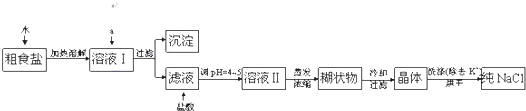
题目内容
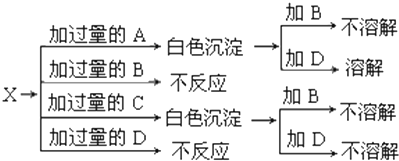 如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.(1)试确定下列各物质的名称:
A:
(2)写出上述过程中涉及到的反应的离子方程式:
①
②
③
考点:无机物的推断
专题:
分析:根据物质间的相互反应及反应现象推断,物质X与这四种物质分别混合能生成两种白色沉淀,KNO3、HNO3不能与其他物质反应生成沉淀,沉淀是由KOH和Ba(NO3)2和X反应生成的,那么白色沉淀就是一种不溶性碱和钡盐;不溶性碱能溶于硝酸,硫酸钡不溶于硝酸.
解答:
解:因为KNO3、HNO3不能与其他物质反应生成沉淀,故X与KOH和Ba(NO3)2反应生成白色沉淀,实质就是X中的金属离子和氢氧根能结合成白色沉淀,X中的酸根离子和钡离子结合成沉淀,故X应该是MgSO4,生成的白色沉淀是氢氧化镁和硫酸钡,氢氧化镁溶于硝酸,硫酸钡不溶于硝酸,由此可推断则A是KOH,B是KNO3,C是Ba(NO3)2,D是HNO3,X是MgSO4,
(1)由以上分析可知A是KOH,B是KNO3,X是MgSO4,
故答案为:氢氧化钾;硝酸钾;硫酸镁;
(2)MgSO4和KOH反应离子方程式为Mg2++2OH-=Mg(OH)2↓;MgSO4和Ba(NO3)2反应离子方程式为SO42-+Ba2+=BaSO4↓;Mg(OH)2和HNO3反应离子方程式为Mg(OH)2+2H+=Mg2++2H2O.故答案为:Mg2++2OH-=Mg(OH)2↓;SO42-+Ba2+=BaSO4↓;Mg(OH)2+2H+=Mg2++2H2O.
(1)由以上分析可知A是KOH,B是KNO3,X是MgSO4,
故答案为:氢氧化钾;硝酸钾;硫酸镁;
(2)MgSO4和KOH反应离子方程式为Mg2++2OH-=Mg(OH)2↓;MgSO4和Ba(NO3)2反应离子方程式为SO42-+Ba2+=BaSO4↓;Mg(OH)2和HNO3反应离子方程式为Mg(OH)2+2H+=Mg2++2H2O.故答案为:Mg2++2OH-=Mg(OH)2↓;SO42-+Ba2+=BaSO4↓;Mg(OH)2+2H+=Mg2++2H2O.
点评:本题考查无机物的推断,注意不溶性碱都能溶于稀硝酸,碳酸盐沉淀都能溶于稀硝酸,硫酸钡和氯化银不溶于稀硝酸.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
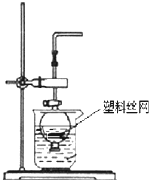 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )
用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )| A、用块状大理石与稀硫酸反应制取CO2 |
| B、用锌粒与稀硫酸反应制取H2 |
| C、用过氧化钠与水反应制取O2 |
| D、用二氧化锰与浓盐酸反应制取Cl2 |
X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍;Y最高价与最低价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2.下列说法不正确的是( )
| A、存放W单质的仓库失火不能用CO2灭火 |
| B、Z的氧化物通常形成分子晶体 |
| C、Y的单质能把溴从溴化物中置换出来 |
| D、X的氢化物可以是两种液体 |
下列离子方程式中,错误的是( )
| A、氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| B、氯气与KOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| C、盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ |
| D、NaCl溶液与AgNO3溶液反应:Cl-+Ag+=AgCl↓ |
下列离子方程式中书写正确的是( )
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Fe和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol/L 的氨水b L
②c(OH-)=1×10-3 mol/L 的氨水c L
③pH=11的Ba(OH)2溶液d L.
①1×10-3 mol/L 的氨水b L
②c(OH-)=1×10-3 mol/L 的氨水c L
③pH=11的Ba(OH)2溶液d L.
| A、a=b>c>d |
| B、b>a=d>c |
| C、a=b>d>c |
| D、c>a=d>b |