题目内容
1.已知:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次递增.A元素的含量在宇宙中最丰富,B元素的一种核素可以鉴定文物的年代,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:(1)E和F两种元素的氢化物相比较,还原性较强的是硫化氢(写名称).
(2)D元素的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,该供氧过程的化学方程式为+2CO2=2Na2CO3+O2↑.
(3)元素F的单质常温下是一种有色气体,工业上主要是通过电解其饱和的钠盐溶液的方法获得该气体,该过程的化学方程式为2H2O+2NaCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH.
(4)元素A、D、E与钠元素可以形成两种均含有这四种元素的酸式盐,这两种酸式盐在水溶液中发生反应的离子方程式是H++HSO3-=SO2↑+H2O.
(5)C与F两种元素的气态氢化物发生反应的基本反应类型是化合反应,生成物中有一种盐,该盐的水溶液呈酸(填“酸”“碱”或“中”)性,该盐的水溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(Cl-).
(6)由元素A、B、D组成的一元酸M为生活中常见的一种的调味品的主要成分,由元素A、F组成的化合物为N.常温下,向氢离子浓度相同、溶液体积相同的M、N的两种溶液中分别加入等质量的锌粉,如果反应后仅有一份溶液中存在着剩余的锌粉,则反应过程中两种溶液反应速率的大小关系是:M>N(填“>”“=”或“<”).
分析 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次递增.A元素的含量在宇宙中最丰富,则A为H元素;B元素的一种核素可以鉴定文物的年代,则B为碳元素;C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,则C为N元素;D与E同主族,E处于第三周期,E元素原子的最外层电子数比次外层电子数少2,最外层电子数为6,则E为S元素、D为O元素,可推知F为Cl.
(1)非金属性越强,氢化物还原性越弱;
(2)过氧化钠与二氧化碳反应生成碳酸钠与氧气;
(3)工业上用电解饱和食盐水的方法制备氯气,反应生成氢氧化钠、氢气与氯气;
(4)硫酸氢钠和亚硫酸氢钠都是强电解质,二者反应生成二氧化硫与水;
(5)氨气与氯化氢发生化合反应生成NH4Cl,NH4Cl溶液中NH4+水解,溶液呈酸性,NH4+离子水解,所以NH4+离子浓度小于氯离子;
(6)由日常生活中的调味品可知H、C、O组成的X是醋酸,Y是HCl,等pH的CH3COOH、HCl溶液,醋酸的浓度远远大于盐酸,随着反应的进行CH3COOH?CH3COO-+H+向右移动,醋酸中c(H+)大于盐酸中的.
解答 解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次递增.A元素的含量在宇宙中最丰富,则A为H元素;B元素的一种核素可以鉴定文物的年代,则B为碳元素;C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,则C为N元素;D与E同主族,E处于第三周期,E元素原子的最外层电子数比次外层电子数少2,最外层电子数为6,则E为S元素、D为O元素,可推知F为Cl.
(1)非金属性S<Cl,故硫离子的还原性大于氯离子,所以还原性较强的是硫化氢,
故答案为:硫化氢;
(2)过氧化钠与人呼出的二氧化碳反应,生成人呼吸所需要的氧气,该过程的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2↑,
故答案为:+2CO2=2Na2CO3+O2↑;
(3)工业上用电解饱和食盐水的方法制备氯气,化学方程式为:2H2O+2NaCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,
故答案为:2H2O+2NaCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(4)硫酸氢钠和亚硫酸氢钠都是强电解质,它们反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(5)氨气与氯化氢发生化合反应生成NH4Cl,NH4Cl溶液中NH4+水解,溶液呈酸性,NH4+离子水解,所以NH4+离子浓度小于氯离子,离子浓度为:c(OH-)<c(H+)<c(NH4+)<c(Cl-),
故答案为:化合反应;酸;c(OH-)<c(H+)<c(NH4+)<c(Cl-);
(6)由日常生活中的调味品可知H、C、O组成的X是醋酸,Y是HCl,等pH的CH3COOH、HCl溶液,醋酸的浓度远远大于盐酸,随着反应的进行CH3COOH?CH3COO-+H+向右移动,醋酸中c(H+)大于盐酸中的,所以醋酸中的反应速率大于盐酸中的,
故答案为:>.
点评 本题比较综合,涉及元素周期律、周期表的结构、过氧化钠的化学性质、氯气的工业制备、一元强酸和一元弱酸的比较、简单的盐类水解的知识,需要学生熟练掌握基础知识,难度不大.

 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中NaClO是氧化剂 | |
| C. | Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2molFeCl3发生反应,转移电子的物质的量为6mol |
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 |
| 序号 | 实验内容 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 除去氯化钙溶液中的氯化铁杂质 | 碳酸钙 | 调节溶液的pH为3.7,再过滤 |
| A. | ①②③ | B. | ③ | C. | ①② | D. | ①③ |
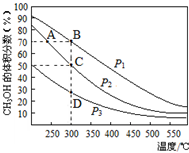 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2 | |
| B. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| C. | 在C点时,CO转化率为75% | |
| D. | 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
| A. | 向卤代烃水解后的溶液中加入AaNO3溶液,根据沉淀颜色可以判断卤素原子种类 | |
| B. | 银镜反应、乙酸乙酯的水解反应、苯的硝化反应均需水浴加热 | |
| C. | 甲酸酯、葡萄糖、麦芽糖均能发生银镜反应 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是为了得到更多的乙烯、丙烯等气态短链烃 |
| A. | 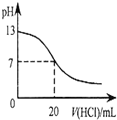 表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 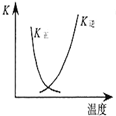 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 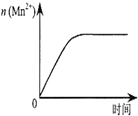 表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. |  图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
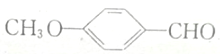 的同分异构体,符合下列条件,写出H的结构简式:
的同分异构体,符合下列条件,写出H的结构简式: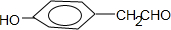 .
.