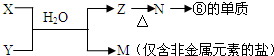题目内容
1.怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式).(1)铁粉中混有铝粉2Al+2OH-+2H2O═2AlO2-+3H2↑
(2)Na2CO3溶液中混有NaHCO3HCO3-+OH-=H2O+CO32-
(3)FeCl2溶液中混有CuCl2Fe+Cu2+=Cu+Fe2+
(4)FeCl3溶液中混有FeCl22Fe2++Cl2═2Fe3++2Cl-.
分析 (1)Al与NaOH溶液反应,而Fe不能,以此除杂;
(2)氢氧化钠可与NaHCO3反应生成碳酸钠和水;
(3)FeCl2溶液中混有CuCl2加人过量的铁粉;
(4)将亚铁离子氧化生成铁离子,不能引入新杂质.
解答 解:(1)Al与NaOH溶液反应,而Fe不能,选NaOH溶液来除杂,发生离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)氢氧化钠可与NaHCO3反应生成碳酸钠和水,离子方程式为HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
(3)FeCl2溶液中混有CuCl2加人过量的铁粉,反应的离子方程式为Fe+Cu2+=Cu+Fe2+,故答案为:Fe+Cu2+=Cu+Fe2+;
(4)将亚铁离子氧化生成铁离子,不能引入新杂质,则选择向溶液中通氯气除杂,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-.
点评 本题考查除杂及离子反应方程式的书写,为高考常见题型,注意除杂的原则及物质的性质即可解答,侧重氧化还原反应的考查,题目难度不大.

练习册系列答案
相关题目
12.下列关于二氧化硅晶体的描述错误的是( )
| A. | 分子式为SiO2 | B. | 熔化时共价键断裂 | ||
| C. | 属于酸性氧化物 | D. | 1mol SiO2中含有4 mol Si-O键 |
16.下列溶液中氯离子的物质的量浓度与50mL 1mol•L-1氯化铝溶液中氯离子的物质的量浓度相等的是( )
| A. | 150mL 1mol•L-1氯化钠溶液 | B. | 75mL 1.5mol•L-1氯化钙溶液 | ||
| C. | 150mL 3mol•L-1氯酸钾溶液 | D. | 50mL 1mol•L-1氯化镁溶液 |
10.在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及其硫酸盐的信息,用以证明火星上存在或曾经存在过水,以下叙述正确的是( )
| A. | Fe2O3 与Fe3O4互为同素异形体 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 将CO2通入BaCl2溶液中至饱和,有沉淀产生 | |
| D. | 制备Al用电解法,制备Fe、Cu可用还原法 |
11.进行化学实验操作必须正确、规范.下列说法中不正确的是( )
| A. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)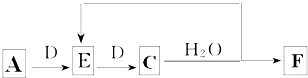
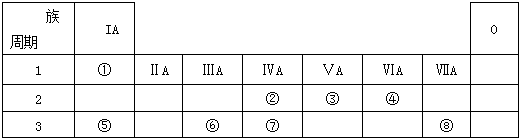
 .
.