题目内容
15. 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑
CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C
CaCN2+2H2O═NH2CN+Ca(OH)2
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的价层电子排布式3d104s2.CaCN2中阴离子为CN${\;}_{2}^{2-}$,与CN${\;}_{2}^{2-}$互为等电子体的分子有N2O和CO2(填化学式),由此可以推知CN${\;}_{2}^{2-}$的空间构型为直线形.
(2)尿素分子中C原子采取sp2杂化.
(3)三聚氰胺
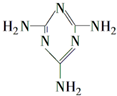 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸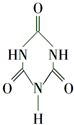 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.A.共价键 B.离子键 C.分子间氢键
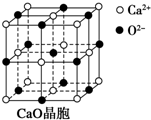
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为6.已知CaO晶体的密度为ρ,用NA表示阿伏加德罗常数,求晶胞中距离最近的两个钙离子之间的距离$\sqrt{2}$$\root{3}{\frac{28}{ρ×6.02×1{0}^{23}}}$(已知Ca-40、O-16,列出计算式).CaO晶体和NaCl晶体的晶格能分别为CaO 3 401kJ•mol-1、NaCl 786kJ•mol-1.导致两者晶格能差异的主要原因是CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量.
分析 (1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理写出该原子的核外电子排布式;根据等电子体的概念确定与CN22-互为等电子体的分子,根据二氧化碳的空间构型确定CN22-离子的空间构型;
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式;
(3)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;密度等于质量除体积,摩尔质量除阿佛加德罗常数等于一个分子的质量,选择CaO晶胞中的小立方体模型列式求解钙离子间距;晶格能大小与离子带电量成正比,与离子半径成反比.
解答 解:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,价电子排布式为3d104s2;与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形,
故答案为:3d104s2;CO2;直线形;
(2)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化,
故答案为:sp2;
(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石,
故答案为:C;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6;把CaO晶胞看作有8个小立方体无隙并置而成,取$\frac{1}{8}$立方体作为研究对象,利用均摊法计算出Ca 2+、O 2-的个数分别为:4×$\frac{1}{8}$=$\frac{1}{2}$,即含$\frac{1}{2}$个CaO,其质量为$\frac{1}{2}$×$\frac{56}{6.02×10{\;}^{23}}$,设其边长为a,则其体积为a3,据公式ρ=$\frac{m}{V}$得:ρ×a3=$\frac{1}{2}$×$\frac{56}{6.02×10{\;}^{23}}$,a=$\root{3}{\frac{56}{2×ρ×6.02×10{\;}^{23}}}$,从上图可以看出,处于正方形对角线的两个离子的间距最小,所以晶胞中距离最近的两个钙离子之间的距离d=$\sqrt{2}$a=$\sqrt{2}$×$\root{3}{\frac{56}{2×ρ×6.02×10{\;}^{23}}}$=$\sqrt{2}$$\root{3}{\frac{28}{ρ×6.02×1{0}^{23}}}$;晶格能大小与离子带电量成正比,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,
故答案为:6;$\sqrt{2}$$\root{3}{\frac{28}{ρ×6.02×1{0}^{23}}}$;CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量.
点评 本题考查了物质结构知识,难度不大,易错点是配位数的确定,以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数.

 阅读快车系列答案
阅读快车系列答案| A. | 若甲试管溶液呈蓝色,则乙试管溶液一定呈血红色 | |
| B. | 甲试管溶液呈蓝色,丙试管中紫红色褪去,说明滴加氯水后的溶液中一定无 Fe3++ | |
| C. | 乙试管溶液呈血红色,则甲试管溶液不可能呈蓝色 | |
| D. | 若乙试管溶液呈血红色,丙也可能褪色 |
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
| A. | 1mol甲基(-CH3)中含有7NA个电子 | |
| B. | 1L 0.5mol•L-1的(NH4)2SO4溶液中含有NA个NH4+ | |
| C. | 在铜与硫的反应中,1mol铜失去的电子数为NA | |
| D. | 36g C5H12分子中含有8NA个共价键 |
| A. | 常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA | |
| B. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| C. | 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA | |
| D. | 62gNa2O溶于水后所得溶液中含有O2-离子数为NA |
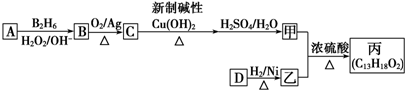
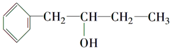 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
,该反应的类型是取代反应.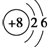 .
.