题目内容
5.下列各组中的两种溶液,不用其他试剂就可以鉴别开的是( )①Na2CO3,H2SO4 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl.
| A. | 全部 | B. | ②③④ | C. | ③④ | D. | ①③④ |
分析 FeCl3溶液呈黄色,不加其他试剂就可以鉴别,可通过溶液的相互滴加,顺序不同,能产生不同的现象,结合对应物质的性质解答该题.
解答 解:①Na2CO3与硫酸,向硫酸中加碳酸钠,开始就生成气体,而向碳酸钠中加硫酸,先没有气体后生成气体,现象不同,可鉴别,故正确;
②FeCl3溶液呈黄色,不加其他试剂就可以鉴别,故正确;
③AlCl3与NaOH,向NaOH溶液中加氯化铝先没有沉淀后有沉淀,而向氯化铝中加NaOH先有沉淀后沉淀消失,现象不同,可鉴别,故正确;
④NaAlO2与盐酸,NaAlO2加入到盐酸溶液中,先无沉淀生成,后生成沉淀,但把盐酸滴加到NaAlO2先有沉淀生成,然后溶解,滴加顺序不同,现象不同,可鉴别,故正确.
故选A.
点评 本题考查物质的检验和鉴别,题目难度中等,解答该类题目的关键是能把握相关物质的性质,学习中注意积累,注意滴加顺序不同发生的不同化学反应为解答关键.

练习册系列答案
相关题目
13. 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
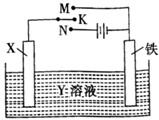
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
20.下列有关元素存在及应用的说法正确的是( )
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 工业制硫酸、硝酸的关键步骤都应用了催化氧化的方法 | |
| C. | 水泥、玻璃、光导纤维都是硅酸盐产品 | |
| D. | 钠、铝、铁、硫、氯等元素在自然界中只有化合态存在 |
10.H2O2水溶液俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口.下列反应中H2O2仅体现氧化性的是( )
| A. | H2O2+Ba(OH)2═BaO2+2H2O | |
| B. | Ag2O+H2O2═2Ag+O2↑+H2O | |
| C. | 2H2O2═2H2O+O2↑ | |
| D. | 3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O |
17. X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
电子数的3倍,下列说法中不正确的是( )
 X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层电子数的3倍,下列说法中不正确的是( )
| A. | 气态氢化物的稳定性:Y>Z | |
| B. | 最高价氧化物物对应水化物酸性:Z>W | |
| C. | X的气态氢化物与Y、Z、W的气态氢化物都可以反应 | |
| D. | 气态氢化物的沸点,Y最高 |
14.在2L密闭恒容容器中投入一定量碳酸镁,在不同的温度下进行反应.MgCO3(s)?MgO(s)+CO2(g)△H,c02的.质的量如下表所示,下列推断不正确的是
| 温度 物质的量 时间 | 2min | 4min | 6min | 8min | 10min | 12min |
| 450℃ | 0.2mol | 0.3mol | 0.35mol | 0.40mol | 0.50mol | 0.50mol |
| 480℃ | 0.25mol | 0.35mol | 0.45mol | 0.60mol | 0.60mol | 0.60mol |
| A. | 该反应是熵增,焓增的反应,在较高温度下能自发进行 | |
| B. | 恒温恒压,达到新平衡时,c(CO2)不变,c(MgCO3)增大 | |
| C. | 在2~8min之间CO2平均速率v(CO2)=$\frac{1}{30}$mol•L-1•min-1 | |
| D. | 升高温度,该反应平衡常数、分解速率和MgCO3分解率都增大. |
6.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=$\frac{4}{{t}_{1}v}$mol/(L•min)
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566 kJ/mol.
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=$\frac{4}{{t}_{1}v}$mol/(L•min)
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566 kJ/mol.
 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: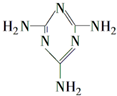 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸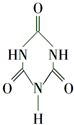 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.