题目内容
6.常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=1.0×10-3mol•L-1,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=1.0×10-11mol•L-1.分析 在CH3COONa溶液中,OH-全部来自于水的电离,结合溶液中离子积常数计算水电离出的氢离子浓度判断;溶液中pH=-lgc(H+),而在酸溶液中,氢离子几乎全部来自于酸的电离,但氢氧根全部来自于水的电离,而水电离出的c(H+)等于溶液中c(OH-),据此分析;
解答 解:在CH3COONa溶液中,OH-全部来自于水的电离,由于溶液的pH=11,故溶液中的氢离子浓度为10-11mol/L,由水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=1.0×10-3 mol•L-1;
pH等于3的CH3COOH溶液中C(H+)=1.0×10-3mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1.0×10-11mol/L,而在酸溶液中,氢离子几乎全部来自于酸的电离,但氢氧根全部来自于水的电离,故由水电离出的C(H+)=c(OH-)=1.0×10-11mol/L,
故答案为:1.0×10-3 mol•L-1;1.0×10-11mol/L.
点评 本题考查盐溶液中和酸溶液中的来自于水的氢离子浓度的计算,正确理解混合溶液pH计算的方法等即可解答,会正确计算盐溶液中水电离出c(H+),为易错点.

练习册系列答案
相关题目
16.下列现象不能用胶体的性质解释的是( )
①用氯气对自来水消毒 ②用石膏或盐卤点制豆腐 ③清晨的阳光穿过茂密的林木枝叶产生美丽的光圈 ④在NaCl溶液中滴入AgNO3溶液产生沉淀 ⑤长江水在入海口形成三角洲.
①用氯气对自来水消毒 ②用石膏或盐卤点制豆腐 ③清晨的阳光穿过茂密的林木枝叶产生美丽的光圈 ④在NaCl溶液中滴入AgNO3溶液产生沉淀 ⑤长江水在入海口形成三角洲.
| A. | ①② | B. | ②③⑤ | C. | ①④ | D. | 只有④ |
17.下列实验可行的是( )
| A. | 苯、CCl4、酒精可用来萃取溴水中的溴 | |
| B. | 用激光笔鉴别Fe(OH)3胶体和FeCl3溶液 | |
| C. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
11.下列物质不能用于食品添加剂的是( )
| A. | 甲醛 | B. | 食盐 | C. | 蔗糖 | D. | 味精 |
18.铁及其化合物在日常生活、生产中应用广泛.
(1)在某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为B(填字母).
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
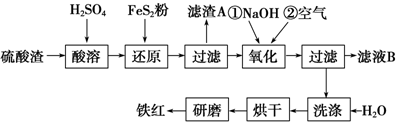
①酸溶过程中Fe2O3发生反应的离子方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成分的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4.
请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO${\;}_{4}^{2-}$+16H+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8.
如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见上表).
⑤滤液B可以回收的物质有ABD(填序号).
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4.
(1)在某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为B(填字母).
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3发生反应的离子方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成分的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4.
请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO${\;}_{4}^{2-}$+16H+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
⑤滤液B可以回收的物质有ABD(填序号).
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4.
 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: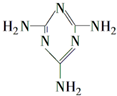 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸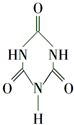 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.