题目内容
3.有机物丙(C13H18O2)是一种香料,其合成路线如图所示.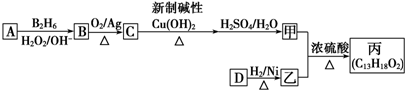
已知:①R-CH═CH2$→_{H_{2}O_{2}/OH-}^{B_{2}H_{6}}$R-CH2CH2OH;
②质谱图表明甲的相对分子质量为88,它的核磁共振氢谱显示有3组峰;
③乙是
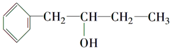 的同系物.
的同系物.回答下列问题:
(1)A的化学名称是2-甲基丙烯.
(2)B的分子式是C4H10O.
(3)C与新制碱性Cu(OH)2反应的化学方程式是(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$(CH3)2CHCOONa+Cu2O↓+3H2O.
(4)丙中有两个甲基,在一定条件下,1mol D可以和2mol H2反应生成乙,D可以发生银镜反应,则D的结构简式为
 .
.(5)甲与乙反应的化学方程式为
 ,该反应的类型是取代反应.
,该反应的类型是取代反应.(6)甲的同分异构体中符合下列条件的共有2种.
①含有“-COO-”结构;②核磁共振氢谱有3组峰且峰面积比为3:2:3.
分析 结合信息及转化关系可知A为烃,质谱法测得A的相对分子质量为56,分子中C原子数目最大数=$\frac{56}{12}$=4…8,故A为C4H8,它的核磁共振氢谱显示只有2组峰,可推知A为(CH3)2C=CH2 ,顺推可知B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,甲为(CH3)2CHCOOH,甲和乙反应生成有机物C13H18O2,应是发生酯化反应,则乙为醇,甲中含有4个碳原子,所以乙中含有9个碳原子,乙的分子式为:C9H12O,D可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol D与2mol H2反应可以生成乙,丙中含有两个-CH3,而甲中含有2个甲基,故乙中没有甲基,可推知D为 ,乙为
,乙为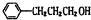 ,据此解答.
,据此解答.
解答 解:结合信息及转化关系可知A为烃,质谱法测得A的相对分子质量为56,分子中C原子数目最大数=$\frac{56}{12}$=4…8,故A为C4H8,它的核磁共振氢谱显示只有2组峰,可推知A为(CH3)2C=CH2 ,顺推可知B为CH3)2CHCH2OH,C为(CH3)2CHCHO,甲为(CH3)2CHCOOH,甲和乙反应生成有机物C13H18O2,应是发生酯化反应,则乙为醇,甲中含有4个碳原子,所以乙中含有9个碳原子,F的分子式为:C9H12O,D可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol D与2mol H2反应可以生成乙,丙中含有两个-CH3,而甲中含有2个甲基,故乙中没有甲基,可推知D为 ,乙为
,乙为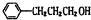 ,
,
(1)由上述分析可知,A的结构简式为:(CH3)2C=CH2 ,名称为2-甲基丙烯,
故答案为:2-甲基丙烯;
(2)B为(CH3)2CHCH2OH,分子式为C4H10O,
故答案为:C4H10O;
(3)C为(CH3)2CHCHO,与新制Cu(OH)2悬浊液反应的化学方程式为:(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$(CH3)2CHCOONa+Cu2O↓+3H2O,
故答案为:(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$(CH3)2CHCOONa+Cu2O↓+3H2O;
(4)根据上面的分析可知,D为 ,
,
故答案为: ;
;
(5)甲与乙反应的化学方程式为: ,该反应为取代反应,
,该反应为取代反应,
故答案为: ;取代反应;
;取代反应;
(6)甲为(CH3)2CHCOOH,根据条件①含有“-COO-”结构;②核磁共振氢谱有3组峰且峰面积比为3:2:3,即含有三种位置的氢原子,则符合条件的甲的同分异构体为CH3CH2COOCH3、CH3COOCH2CH3,其2种,
故答案为:2.
点评 本题考查有机物推断,需要对给予的信息进行利用,能较好的考查学生阅读获取信息能力,确定A的结构简式是关键,利用正推法与逆推法相结合进行推断,注意掌握官能团的性质与转化,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 甲醛 | B. | 食盐 | C. | 蔗糖 | D. | 味精 |
(1)在某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为B(填字母).
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
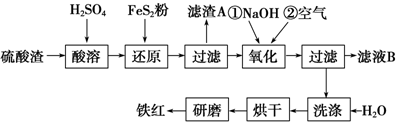
①酸溶过程中Fe2O3发生反应的离子方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成分的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4.
请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO${\;}_{4}^{2-}$+16H+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
⑤滤液B可以回收的物质有ABD(填序号).
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4.
| A. | 原电池负极发生氧化反应 | |
| B. | 原电池工作时溶液中的阳离子向正极移动 | |
| C. | 原电池工作时电子由负极沿导线流向正极,再经电解质溶液流回负极 | |
| D. | 原电池反应一定属于氧化还原反应 |
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
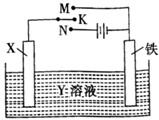
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
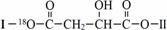 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.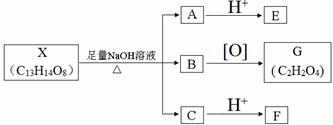
 .
.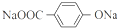 ;X的结构简式是
;X的结构简式是 .
.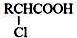 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
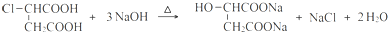 .
.
 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: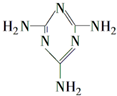 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸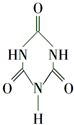 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.