题目内容
3.如图是四种常见有机物的比例模型示意图,下列说法正确的是( )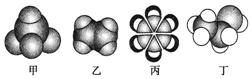
| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙可以从煤焦油中获得 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
分析 根据原子成键特点知,碳原子能形成4个共价键、H原子能形成1个共价键、O原子能形成2个共价键,根据分子比例模型及原子成键特点知,甲、乙、丙、丁分别是甲烷、乙烯、苯和乙醇,
A.甲烷性质较稳定,不易被一般的强氧化剂氧化;
B.碳碳不饱和键能和溴发生加成反应;
C.从煤焦油中可以获取苯;
D.乙醇和乙酸在浓硫酸作催化剂、加热条件下发生取代反应.
解答 解:根据原子成键特点知,碳原子能形成4个共价键、H原子能形成1个共价键、O原子能形成2个共价键,根据分子比例模型及原子成键特点知,甲、乙、丙、丁分别是甲烷、乙烯、苯和乙醇,
A.甲烷性质较稳定,不易被一般的强氧化剂氧化,所以甲烷不易被酸性高锰酸钾溶液氧化,所以不能使酸性高锰酸钾溶液褪色,故A错误;
B.碳碳不饱和键能和溴发生加成反应,乙烯中含有碳碳双键,所以能和溴发生加成反应而使溴水褪色,故B错误;
C.从煤焦油中可以获取苯,则丙可以从煤焦油中获得,故C正确;
D.乙醇和乙酸在浓硫酸作催化剂、加热条件下发生取代反应生成乙酸乙酯,乙酸乙酯在稀硫酸、加热条件下发生水解反应生成乙醇,故D错误;
故选C.
点评 本题考查有机物结构和性质,侧重考查学生分析、判断及知识运用能力,明确原子成键特点及官能团与性质关系是解本题关键,注意:酯化反应也属于取代反应,题目难度不大.

练习册系列答案
相关题目
13.下列说法不正确的是( )
| A. | HClO、H2CO3、HNO3、HClO4的酸性依次增强 | |
| B. | NaCl中混有KNO3,可用蒸发结晶趁热过滤得到NaCl | |
| C. | HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键 | |
| D. | 以极性键结合的分子不一定是极性分子 |
14.分别在相同物质的量浓度、相同体积的H2SO3、NaHSO3、Na2SO3三种溶液中,滴加同一新制氯水.其导电能力随氯水体积变化的曲线如图所示(不考虑空气的影响).下列分析正确的是( )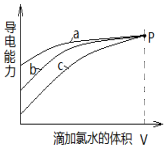

| A. | 曲线a代表H2SO3溶液 | |
| B. | 曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3-)+c(SO32-)+c(SO42-) | |
| C. | 曲线a、b、c代表的溶液中均始终保持:2c(Cl-)=c(SO42-) | |
| D. | 当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同 |
8.下列有机物,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
| A. | 1-溴丁烷 | B. | 2,2-二甲基-1-丁醇 | ||
| C. | 3-戊醇 | D. | 2-甲基-3-氯戊烷 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(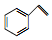 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的最外层电子数是其次外层电子数的三倍,Z元素是光导纤维的组成元素之一,W与Z同主族,R与Y的原子核外电子数之比为2:1,下列叙述错误的是( )
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
14.两种气态烃的混合物共2.24L(标准状况下),完全燃烧后得3.36L(标准状况下)二氧化碳和2.7g的水.下列说法中,正确的是( )
| A. | 混合气体中一定含有甲烷 | B. | 混合气体中一定含有乙烯 | ||
| C. | 混合气体中一定不含有乙炔 | D. | 混合气体中一定含有乙烷 |
 的单体的结构简式是CH2=CH-CH=CH2和
的单体的结构简式是CH2=CH-CH=CH2和 .
.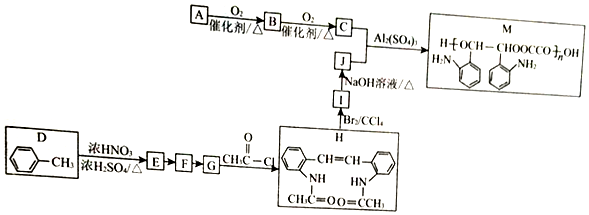
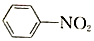 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$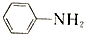 (-NH3容易被氧化)
(-NH3容易被氧化) $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$
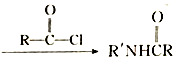 (R和R′代表烃基)
(R和R′代表烃基)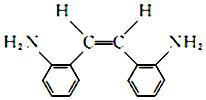 .
.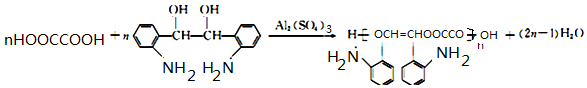 .
.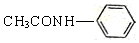 的合成路线
的合成路线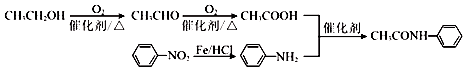 .
.