题目内容
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(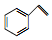 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
分析 A.1个甲基含有9个电子;
B.25℃时,1 L pH=ll的氨水中氢氧根离子物质的量浓度为0.001mol/L,依据N=CVNA计算氢氧根离子个数;
C.苯环中不含有碳碳双键;
D.合成氨为可逆反应,不能进行到底.
解答 解:A.1 mol-CH3中含有的质子数为9NA,故A错误;
B.25℃时,1 L pH=ll的氨水中氢氧根离子物质的量浓度为0.001mol/L,则含有氢氧根离子个数为:0.001mol/L×1L×NA=0.001NA,故B正确;
C.1 mol苯乙烯( )中含有的碳碳双键数为1NA,故C错误;
)中含有的碳碳双键数为1NA,故C错误;
D.合成氨为可逆反应,不能进行到底,28 g N2与足量H2,不能完全反应,则转移电子数小于6 NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确有机物结构特点,熟悉以物质的量为核心计算公式是解题关键,注意苯环中碳碳键为介于单键与双键之间独特的化学键,题目难度中等.

练习册系列答案
相关题目
5.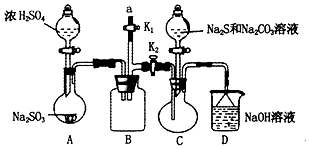 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
(1)实验开始的步骤,组装好仪器检查装置气密性,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2S2O3混合溶液,再向A中烧瓶滴加浓H2SO4.
(2)C中的烧瓶发生如下反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是硫;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因S2O32-+2H+=S↓+SO2↑+H2O.
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3溶液.
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是在a处连接盛NaOH溶液的注射器,再关闭K2打开K1.
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取.为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
①实验1、2的目的是探究亚硫酸钠浓度 对亚硫酸钠转化率的影响;
②若要完成表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行 次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为.硫为固体,不影响化学平衡的移动.
 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.(1)实验开始的步骤,组装好仪器检查装置气密性,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2S2O3混合溶液,再向A中烧瓶滴加浓H2SO4.
(2)C中的烧瓶发生如下反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是硫;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因S2O32-+2H+=S↓+SO2↑+H2O.
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3溶液.
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是在a处连接盛NaOH溶液的注射器,再关闭K2打开K1.
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取.为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
| 2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
②若要完成表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行 次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为.硫为固体,不影响化学平衡的移动.
6.室温下,下列离子组在给定条件下一定能大量共存的是( )
| A. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| B. | Na2S溶液中:K+、Na+、NO3-、Ag+ | |
| C. | 含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br- | |
| D. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、CO32- |
3.如图是四种常见有机物的比例模型示意图,下列说法正确的是( )
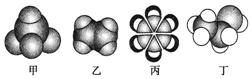

| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙可以从煤焦油中获得 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
10.图装置中,“→”表示电子的移动方向,则电极材料A、B分别可能是( )


| A. | 石墨、石墨 | B. | Cu、Al | C. | Mg、石墨 | D. | Ag、Zn |
20.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A. | 该有机物属于烃 | B. | 该化合物的分子式一定是CH4O | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定不含有氧元素 |
7.下列溶液一定呈中性的是( )
| A. | c(H+)=c(OH-) | B. | pH=7 | C. | KW=10-14 | D. | c(H+)=10-7mol/L |
4.氮化铝(AlN)熔融时不导电、难溶于水,常用作砂轮及耐高温材料,由此推知,它应该属于( )
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
6.下列化合物的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |