题目内容
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的最外层电子数是其次外层电子数的三倍,Z元素是光导纤维的组成元素之一,W与Z同主族,R与Y的原子核外电子数之比为2:1,下列叙述错误的是( )| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
分析 X的原子半径在短周期主族元素中最大,应为Na元素,Y元素的最外层电子数是其次外层电子数的三倍,应为O元素,Z元素是光导纤维的组成元素之一,为Si元素,W与Z同主族,则W为C元素,R与Y的原子核外电子数之比为2:1,则R为S元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为Na、Y为O、Z为Si、W为C、R为S元素.
A.水分子间存在氢键,沸点较高,且非金属性O>S,则水的氢化物较稳定,故A正确;
B.同周期元素从左到右原子半径逐渐减小,Si>S、C>O,故B错误;
C.X与Y形成的两种化合物为Na2O、Na2O2,且两种化合物中阴阳离子个数比为1:2,故C正确;
D.非金属性S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故D正确.
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,涉及原子构成、原子核外电子排布、同一周期内元素性质的递变规律与原子结构的关系及金属、非金属在元素周期表中的位置及其性质递变的规律,明确物质结构和元素性质是解本题关键,易错选项是A,氢化物的稳定性与化学键有关、氢化物的熔沸点与分子间作用力及氢键有关,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
3.如图是四种常见有机物的比例模型示意图,下列说法正确的是( )
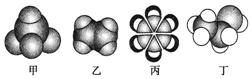

| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙可以从煤焦油中获得 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
20.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A. | 该有机物属于烃 | B. | 该化合物的分子式一定是CH4O | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定不含有氧元素 |
7.下列溶液一定呈中性的是( )
| A. | c(H+)=c(OH-) | B. | pH=7 | C. | KW=10-14 | D. | c(H+)=10-7mol/L |
17.下列实验设计能达到实验目的是( )
| 选项 | 实验目的 | 实验设计 |
| A | 除去CO2气体中的HCl | 依次通过饱和Na2CO3溶液和浓H2SO4 |
| B | 测定NaOH溶液的浓度 | 以酚酞作指示剂,用标准盐酸滴定 |
| C | 分离提纯蛋白质 | 往蛋白质溶液中加入饱和CuSO4溶液 |
| D | 证明HClO为弱酸 | 用pH试纸测定NaClO溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
4.氮化铝(AlN)熔融时不导电、难溶于水,常用作砂轮及耐高温材料,由此推知,它应该属于( )
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
2.下列不是化石能源的是( )
| A. | 天然气 | B. | 潮汐 | C. | 煤 | D. | 石油 |
3.下列说法正确的是( )
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |