题目内容
13.下列说法不正确的是( )| A. | HClO、H2CO3、HNO3、HClO4的酸性依次增强 | |
| B. | NaCl中混有KNO3,可用蒸发结晶趁热过滤得到NaCl | |
| C. | HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键 | |
| D. | 以极性键结合的分子不一定是极性分子 |
分析 A.含氧酸中非羟基氧原子个数越多,酸性越强;
B.二者溶度积受温度的影响不同;
C.HCl与水不能形成氢键;
D.甲烷为含极性键的非极性分子,HCl为含极性键的极性分子,分子极性与结构对称性、正负电荷中心是否重合有关.
解答 解:A.HClO、H2CO3、HNO3、HClO4中非羟基O原子个数增多,则酸性依次增强,故A正确;
B.NaCl中混有KNO3,二者溶度积受温度的影响不同,则可用蒸发结晶趁热过滤得到NaCl,故B正确;
C.NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键,而HCl不能,故C错误;
D.以极性键结合的分子不一定是极性分子,化学键与分子极性无直接关系,如甲烷为含极性键的非极性分子,HCl为含极性键的极性分子,故D正确;
故选C.
点评 本题考查原子结构与周期律,为高频考点,把握酸性比较、氢键、混合物分离提纯等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
3.在一定温度下容积不变的容器中能说明反应:C(s)+H2O(g)?CO(g)+H2(g) 达到化学平衡状态的是( )
①气体的压强不变
②每生成n个CO分子同时生成n个H2分子
③四种物质的分子数之比为1:1:1:1
④气体的密度不变
⑤断裂2n个H-O键同时断裂n个H-H键
⑥气体的平均摩尔质量不变.
①气体的压强不变
②每生成n个CO分子同时生成n个H2分子
③四种物质的分子数之比为1:1:1:1
④气体的密度不变
⑤断裂2n个H-O键同时断裂n个H-H键
⑥气体的平均摩尔质量不变.
| A. | ①④⑤⑥ | B. | ②⑤⑥ | C. | ①⑤⑥ | D. | ①②④⑤⑥ |
4.下列说法不正确的是( )
| A. | Penguinone分子 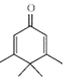 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol  分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
1.当运动员肌肉扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(沸点为12.27℃)进行局部冷冻麻醉应急处理.下列关于氯乙烷的说法中不正确的是( )
| A. | 氯乙烷与水互不相溶 | |
| B. | 氯乙烷中含有两种官能团 | |
| C. | 氯乙烷在一定条件下能发生消去反应 | |
| D. | 氯乙烷的结构只有一种 |
8.下列说法中,正确的是( )
| A. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料,最有潜力的应用是成为硅的替代品用来生产未来的超级计算机 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 为迎接G20峰会,全温州市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
18.下列关于物质的分类中正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 矿泉水 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化铁胶体 | 氯化银 | 一水合氨 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
5.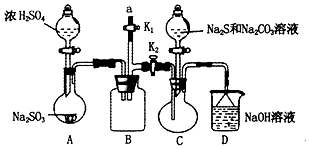 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
(1)实验开始的步骤,组装好仪器检查装置气密性,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2S2O3混合溶液,再向A中烧瓶滴加浓H2SO4.
(2)C中的烧瓶发生如下反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是硫;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因S2O32-+2H+=S↓+SO2↑+H2O.
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3溶液.
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是在a处连接盛NaOH溶液的注射器,再关闭K2打开K1.
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取.为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
①实验1、2的目的是探究亚硫酸钠浓度 对亚硫酸钠转化率的影响;
②若要完成表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行 次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为.硫为固体,不影响化学平衡的移动.
 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.(1)实验开始的步骤,组装好仪器检查装置气密性,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2S2O3混合溶液,再向A中烧瓶滴加浓H2SO4.
(2)C中的烧瓶发生如下反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是硫;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因S2O32-+2H+=S↓+SO2↑+H2O.
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3溶液.
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是在a处连接盛NaOH溶液的注射器,再关闭K2打开K1.
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取.为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
| 2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
②若要完成表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行 次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为.硫为固体,不影响化学平衡的移动.
3.如图是四种常见有机物的比例模型示意图,下列说法正确的是( )
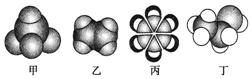

| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙可以从煤焦油中获得 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |