题目内容
14.两种气态烃的混合物共2.24L(标准状况下),完全燃烧后得3.36L(标准状况下)二氧化碳和2.7g的水.下列说法中,正确的是( )| A. | 混合气体中一定含有甲烷 | B. | 混合气体中一定含有乙烯 | ||
| C. | 混合气体中一定不含有乙炔 | D. | 混合气体中一定含有乙烷 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下2.24L混合气体、3.36L二氧化碳的物质的量,再根据n=$\frac{m}{M}$计算出水的物质的量,从而可确定混合物的平均分子式,根据计算结果对各选项进行判断.
解答 解:标况下2.24L混合气体的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
标况下3.36L二氧化碳的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,0.15mol二氧化碳中含有0.15molC,
2.7g水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,0.15mol水中含有0.3molH,
则该混合烃中含有的平均C、H原子数为:N(C)=$\frac{0.15mol}{0.1mol}$=1.5、N(H)=$\frac{0.3mol}{0.1mol}$=3,
该混合烃的平均分子式为:C1.5H3,
碳原子数小于1.5的烃只有甲烷,则一定含有CH4,
甲烷分子中H原子数为4>3,则另一种烃分子中H原子数<3,且C原子数>1.5,满足该条件的烃只有乙炔,
故该气体为甲烷和乙炔的混合烃,只有A正确,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握质量守恒定律、平均值法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.如图是四种常见有机物的比例模型示意图,下列说法正确的是( )
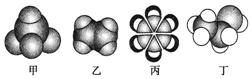

| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙可以从煤焦油中获得 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
4.氮化铝(AlN)熔融时不导电、难溶于水,常用作砂轮及耐高温材料,由此推知,它应该属于( )
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
2.下列不是化石能源的是( )
| A. | 天然气 | B. | 潮汐 | C. | 煤 | D. | 石油 |
19.某有机物A是由下列基团中的两种或多种基团组合而成,A可发生加聚反应、酯化反应,又能与氢氧化钠溶液发生中和反应,则A分子中一定含有的基团是( )
①-OH ②-CH2Cl ③ ④-CH3 ⑤
④-CH3 ⑤ ⑥
⑥
①-OH ②-CH2Cl ③
 ④-CH3 ⑤
④-CH3 ⑤ ⑥
⑥
| A. | ④和⑤ | B. | ②③和④ | C. | ①⑤和⑥ | D. | ③和⑤ |
6.下列化合物的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
3.下列说法正确的是( )
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |
4.根据下列实验操作,预测的实验现象和实验结论或解释正确的是( )
| 实验操作 | 预测的实验现象 | 实验结论或解释 | |
| A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+═H2O+CO2↑ |
| B | 将浓硫酸滴加到盛有铜片的试管中,并将 蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
| C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
| D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
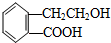 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.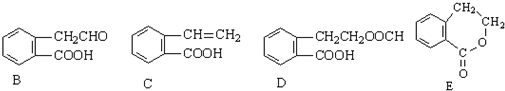
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.