题目内容
19.在给定条件下,下列加下划线的物质在化学反应中能被完全消耗的是( )①用浓盐酸与过量二氧化锰共热制取氯气
②标准状况下,将铝片投入到过量浓硫酸中
③向100mL 3mol•L-1的硝酸中加入5.6g铁
④在5×107Pa、500℃和铁触媒催化的条件下,用物质的量之比为1:3氮气和氢气合成氨
⑤将足量锌粉投入到50mL 18mol•L-1的硫酸中
⑥将足量Ca(ClO)2投入到20mL 10mol•L-1盐酸中
⑦将足量铜投入到50mL 12mol•L-1的硝酸中.
| A. | ②④⑥⑦ | B. | ③⑤⑥⑦ | C. | ④⑤⑥ | D. | ①②③ |
分析 ①浓盐酸随反应的进行浓度减小,当减小到一定浓度不再和二氧化锰反应.
②18.4mol/L的硫酸为浓硫酸,常温下遇到铁、铝金属发生的钝化,不再继续反应.
③向100mL3mol/L的硝酸中加入5.6g铁根据反应的量,铁全部反应生成二价铁离子和三价铁离子;
④合成氨的反应是可逆反应,不可能完全转化;
⑤将足量锌粉投入到50mL 18mol•L-1的硫酸中,首先生成二氧化硫,当浓硫酸转化为稀硫酸时与反应生成氢气,所以硫酸完全转化;
⑥将足量Ca(ClO)2投入到20mL 10mol•L-1盐酸中,发生归中反应生成氯气;
⑦将足量铜投入到50mL 12mol•L-1的硝酸中,首先生成二氧化氮,后来生成一氧化氮气体,硝酸完全转化.
解答 解:①浓盐酸浓度变稀到一定浓度不会和二氧化锰发生氧化还原反应,故错误;
②标准状况下,铝片遇浓硫酸发生钝化,阻止反应进行,故错误;
③根据反应Fe+4HNO3=Fe(NO3)3+NO+2H2O,0.3mol硝酸氧化0.075mol铁为三价铁离子,剩余0.025mol铁会继续和生成的0.1mol三价铁离子反应,依据反应2Fe3++Fe=3Fe2+ 可知剩余0.025mol铁全部溶解需要三价铁离子0.05mol,故正确;
④合成氨的反应是可逆反应,不可能完全转化,故错误;
⑤将足量锌粉投入到50mL 18mol•L-1的硫酸中,首先生成二氧化硫,当浓硫酸转化为稀硫酸时与反应生成氢气,所以硫酸完全转化,故正确;
⑥将足量Ca(ClO)2投入到20mL 10mol•L-1盐酸中,发生归中反应生成氯气,盐酸完全转化,故正确;
⑦将足量铜投入到50mL 12mol•L-1的硝酸中,首先生成二氧化氮,后来生成一氧化氮气体,硝酸完全转化,故正确;
故选B.
点评 本题考查氯气实验室制备中试剂的过程反应,常温下铝、铁在浓硫酸中钝化,变价金属铁与硝酸反应量不同产物不同及其有关过量计算方法,化学反应的可逆性,一定条件下达到平衡.注意审清题意,物质反应时条件不同产物不同,量不同产物不同.

 名校课堂系列答案
名校课堂系列答案| A. | Al | B. | Si | C. | Fe | D. | O |
| A. | N2 | B. | CO2 | C. | SO2 | D. | 氟氯代烷 |
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | |||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ④ | ⑨ |
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),⑤所对应元素的单质工业制备方法为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)用电子式表示元素③与⑧形成化合物的过程
 .
.(4)我国首创以单质⑤-空气-海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光.则电源的负极反应是4Al-12e-=4Al3+,正极反应为3O2+6H2O+12e-=12OH-.
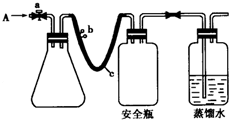 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.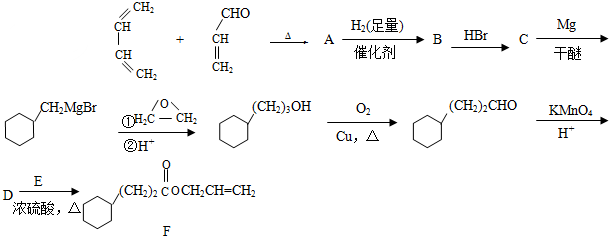
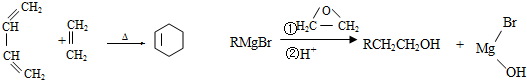
 .
. .
. .
.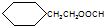
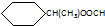 .
.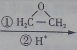 CH3CH2CH2CH2OH(其他试剂任选).
CH3CH2CH2CH2OH(其他试剂任选).