题目内容
2.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的最高价氧化为对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)Z的第一电离能比W的小(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称乙醇、乙酸等
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是Si+4HF=SiF4↑+2H2↑
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol.
分析 短周期元素中,Y是地壳中含量最高的元素,则Y为O元素;X的最高价氧化物对应的水化物化学式为H2XO3,则X的最高化合价为+4,结合原子序数Y>X,可确定X为C元素,Z的基态原子最外层电子排布式为3s23p1,即Z为Al元素;W的一种核素的质量数为28,中子数为14,可确定W的质子数为28-14=14,即W为Si,据此解答.
解答 解:短周期元素中,Y是地壳中含量最高的元素,则Y为O元素;X的最高价氧化物对应的水化物化学式为H2XO3,则X的最高化合价为+4,结合原子序数Y>X,可确定X为C元素,Z的基态原子最外层电子排布式为3s23p1,即Z为Al元素;W的一种核素的质量数为28,中子数为14,可确定W的质子数为28-14=14,即W为Si.
(1)Si位于元素周期表第三周期第ⅣA族,同主族元素原子半径从上到下依次增大,则W(Si)的原子半径比X(C)的要大,
故答案为:三、ⅣA;大;
(2)因周期元素从左到右,元素的第一电离能呈增大趋势,故Z(Al) 的第一电离能比W(Si)的要小.XY2(CO2)为分子晶体,由固态变为气态,克服的是分子间作用力.由C、H、O组成的分子中,存在分子间氢键的物质很多,如:CH3CH2OH、CH3COOH等,
故答案为:小;分子间作用力;乙醇、乙酸等;
(3)Al与盐酸反应生成氯化铝,向反应后的溶液中滴加NaOH溶液直至过量,发生的反应为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,所以看到的现象是:先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液,
W单质为硅,硅和氢氟酸反应生成SiF4和H2两种气体,反应方程式为:Si+4HF=SiF4↑+2H2↑,
故答案为:先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;Si+4HF=SiF4↑+2H2↑;
(4)13.5g Al的物质的量为$\frac{13.5g}{27g/mol}$=0.5mol,Al完全燃烧后恢复至原状态放热419kJ,故4molAl放热为419×8=3352KJ,所以热化学方程式为:2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol;
故答案为:2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol.
点评 本题考查位置结构性质关系应用,明确元素种类是解题关键,注意掌握同周期元素第一电离能异常情况,掌握氢键对物质性质的影响及其存在情况.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案| A. | 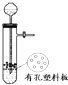 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 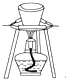 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 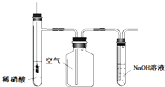 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 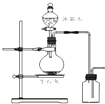 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
| A. | N2 | B. | CO2 | C. | SO2 | D. | 氟氯代烷 |
(1)25℃时,0.05mol•L-1Ba(OH)2溶液的pH=13,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为1:10.
(2)CO2可转化成有机物实现碳循环:CO2$\stackrel{H_{2}}{→}$CH3OH$\stackrel{O_{2}}{→}$HCOOH…
25℃时,几种酸的电离平衡常数如下:
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①用离子方程式表示HCOONa溶液呈碱性的原因HCOO-+H2O?HCOOH+OH-.
②物质的量浓度均为0.1mol•L-1的下列四种物质:
a.Na2CO3b.NaClO c.HCOONa d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(3)常温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度大于HCOONa的水解程度(填“大于”“等于”或“小于”).
(4)含有Cr2O的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O72-.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6mol•L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
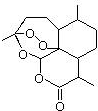
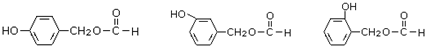
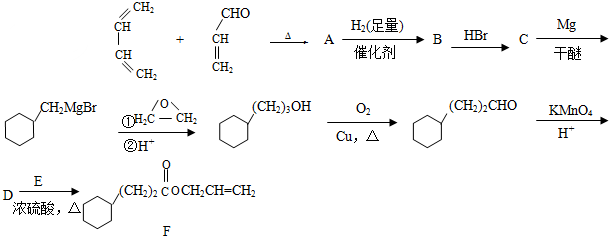
 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)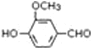 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: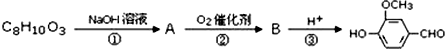
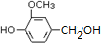 .
. .
.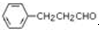 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).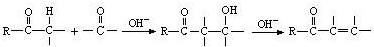
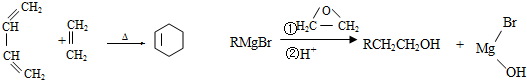
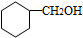 .
.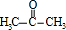 .
. .
.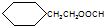
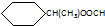 .
.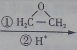 CH3CH2CH2CH2OH(其他试剂任选).
CH3CH2CH2CH2OH(其他试剂任选).