题目内容
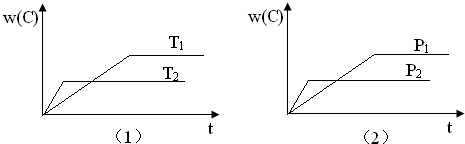
可逆反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数w(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )

| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:由图①可知,根据先拐先平衡,条件高,则温度升高C的百分含量降低,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,同理由②可以看出增大压强,C的百分含量降低,说明增大压强平衡向逆反应方向移动,则应有n<e+f.
解答:
解:A.催化剂只改变化学反应速率,对平衡移动没有影响,故A错误;
B.由图①可知,温度升高C的百分含量降低,说明升高温度平衡向逆反应方向移动,故B正确;
C.由②可以看出增大压强,C的百分含量降低,说明增大压强平衡向逆反应方向移动,则应有n<e+f,故C错误;
D.A为固体,加入A,化学反应速率以及平衡都不发生改变,故D错误.
故选B.
B.由图①可知,温度升高C的百分含量降低,说明升高温度平衡向逆反应方向移动,故B正确;
C.由②可以看出增大压强,C的百分含量降低,说明增大压强平衡向逆反应方向移动,则应有n<e+f,故C错误;
D.A为固体,加入A,化学反应速率以及平衡都不发生改变,故D错误.
故选B.
点评:本题考查化学平衡图象问题,题目难度中等,本题注意根据图象判断外界条件对平衡的移动的影响是解答该题的关键.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A、将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1:20 |
| B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2 c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等 |
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释正确的是( )
| A、Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B、Mg(OH)2的溶度积小于MgCO3的溶度积,且在水中发生了沉淀转化 |
| C、MgCO3电离出的CO32-发生水解,使水中OH-浓度减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp生成Mg(OH)2沉淀 |
| D、MgCO3电离出的CO32-发生水解,使水中OH-浓度增大,对Mg (OH)2的沉淀溶解平衡而言,Qc>Ksp生成Mg(OH)2沉淀 |
下列关于反应能量的说法正确的是( )
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ?mol-1,反应物总能量>生成物总能量 |
| B、相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.则2E1>E2 |
| C、l0lkPa 时,2H2(g)+O2(g)=2H2O(1);△H=-571.6kJ?mol-1,H2的燃烧热为571.6kJ/mol |
| D、H+ (aq)+OH-(aq)=H2O(l);△H=-57.3kJ?mol-1,含 1molNaOH 的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、等物质的量的N2和CO所含分子数均为NA |
| B、2.54g C18H38中含有的共价键数为0.55NA |
| C、1molNa2O2 固体中含离子总数为4 NA |
| D、标准状况下,2.24L戊烷所含分子数为0.1 NA |
根据厦门气象台报道,近年每到春季,厦门市经常出现大雾天气,致使高速公路关闭,航班停飞.雾属于下列分散系中的( )
| A、溶液 | B、悬浊液 |
| C、乳浊液 | D、胶体 |
 低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.