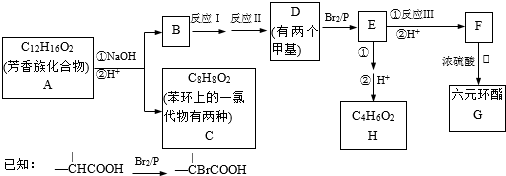
题目内容
多年以前,某城市雾大无风,家庭和工厂排出的烟雾经久不散,每立方米大气中二氧化硫的含量高达3.8mg,烟尘达4.5mg,居民健康普遍受到危害,4天内死亡人数约4000人.回答下列问题:
(1)这种大气污染对人体 系统的危害最大,将会造成 等病症(举两例病症).
(2)为了防止这种污染,硫酸厂可用氨水来吸收SO2,其离子方程式是 .
(3)目前一种有效的方法是用直升机洒白垩粉以降解其污染,其化学方程式是 .
(1)这种大气污染对人体
(2)为了防止这种污染,硫酸厂可用氨水来吸收SO2,其离子方程式是
(3)目前一种有效的方法是用直升机洒白垩粉以降解其污染,其化学方程式是
考点:二氧化硫的污染及治理,二氧化硫的化学性质
专题:
分析:(1)大气中二氧化硫有毒,会对人体呼吸系统的危害最大,将会造成呼吸困难、咳嗽、支气管哮喘、肺气肿等病症;
(2)用氨水将SO2转化为(NH4)2SO3;
(3)二氧化硫和氧化钙反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙;
(2)用氨水将SO2转化为(NH4)2SO3;
(3)二氧化硫和氧化钙反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙;
解答:
解:(1)大气中二氧化硫有毒,会对人体呼吸系统的危害最大,将会造成呼吸困难、咳嗽、支气管哮喘、肺气肿等病症;故答案为:呼吸;呼吸困难、咳嗽、支气管哮喘、肺气肿等
(2)用氨水将SO2转化为(NH4)2SO3离子方程式为:2NH3?H2O+SO2=2NH4++SO32-+H2O,故答案为:2NH3?H2O+SO2=2NH4++SO32-+H2O;
(3)脱硫过程的主要反应为二氧化硫和碳酸钙分解生成的氧化钙反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙,化学方程式为:2CaCO3+2SO2+O2=2CaCO4+2CO2,故答案为:2CaCO3+2SO2+O2=2CaCO4+2CO2.
(2)用氨水将SO2转化为(NH4)2SO3离子方程式为:2NH3?H2O+SO2=2NH4++SO32-+H2O,故答案为:2NH3?H2O+SO2=2NH4++SO32-+H2O;
(3)脱硫过程的主要反应为二氧化硫和碳酸钙分解生成的氧化钙反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙,化学方程式为:2CaCO3+2SO2+O2=2CaCO4+2CO2,故答案为:2CaCO3+2SO2+O2=2CaCO4+2CO2.
点评:此题考查的知识点是酸雨的危害和预防,解答时可以从酸雨的危害表现、预防措施方面来切入.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用某种仪器量取液体体积时,平视时读数为nmL,仰视时读数为x mL,俯视时读数为y mL,若X>n>y,则所用的仪器可能为( )
| A、量筒 | B、容量瓶 |
| C、滴定管 | D、以上均不对 |
下列物质中不属于硅酸盐产品的是( )
| A、陶瓷餐具 | B、水泥 |
| C、普通玻璃 | D、计算机芯片 |
下列元素属于卤族元素的是( )
| A、Cl | B、P | C、He | D、Li |
常温常压时,下列叙述不正确的是( )
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| B、pH=5的①NH4Cl溶液②CH3COOH溶液③稀盐酸溶液中c(H+)水:①>②>③ |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D、0.1 mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则b<a+l |
可逆反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数w(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
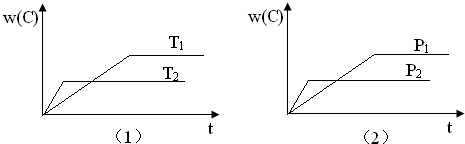

| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
下列变化必须加入其他物质作还原剂才能发生的是( )
| A、CuO→CuCl2 |
| B、CO2→CO |
| C、Cl2→Cl- |
| D、H2O→H2 |