题目内容
已知下列热化学方程式:
①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ?mol-1
②2H2(g)+O2 (g)=2H2O(g)△H=-483.6kJ?mol-1
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=--114.6kJ?mol-1
回答下列问题:H2的燃烧热为 ;反应③的中和热为 .
①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ?mol-1
②2H2(g)+O2 (g)=2H2O(g)△H=-483.6kJ?mol-1
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=--114.6kJ?mol-1
回答下列问题:H2的燃烧热为
考点:燃烧热,中和热
专题:化学反应中的能量变化
分析:燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,中和热是强酸强碱的稀溶液反应生1molH2O放出的热量,据此解答.
解答:
解:H2的燃烧热是指1 mol氢气完全燃烧生成稳定氧化物液态水时所放出的热量,
①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ?mol-1
依据盖斯定律
得:H2(g)+
O2 (g)=H2O(l)△H=-285kJ?mol-1,所以氢气的燃烧热为:285 kJ?mol-1;
中和热是指:强酸强碱的稀溶液反应生1molH2O放出的热量,
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1
依据盖斯定律
得:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ?mol-1,所以反应③的中和热57.3kJ?mol-1;
故答案为:285 kJ?mol-1;57.3kJ?mol-1.
①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ?mol-1
依据盖斯定律
| ① |
| 2 |
| 1 |
| 2 |
中和热是指:强酸强碱的稀溶液反应生1molH2O放出的热量,
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1
依据盖斯定律
| ③ |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:285 kJ?mol-1;57.3kJ?mol-1.
点评:本题考查了燃烧热和中和热的计算,明确燃烧热和中和热的概念和利用盖斯定律计算反应热的方法是解题关键,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
可逆反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数w(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
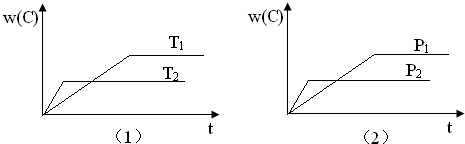

| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
下列说法正确的是( )
| A、在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | ||
| B、由“C(石墨)=C(金刚石);△H=+119kJ?mol-1”可知,金刚石比石墨稳定 | ||
| C、在稀溶液中:H+(aq)+OH q)=H2O(l);△H=-57.3l kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ | ||
D、在101KPa时,2g H2生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+
|
下列变化必须加入其他物质作还原剂才能发生的是( )
| A、CuO→CuCl2 |
| B、CO2→CO |
| C、Cl2→Cl- |
| D、H2O→H2 |
下列电离方程式书写正确的是( )
| A、Ca(OH)2?Ca2++2OH- |
| B、H2SO3?2H++SO32- |
| C、NaHS?Na++HS- |
| D、HCO3-?H++CO32- |
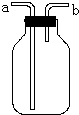 (1)如图的装置在实验室中用途比较广泛:
(1)如图的装置在实验室中用途比较广泛: