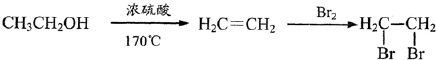题目内容
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A、将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1:20 |
| B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2 c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等 |
考点:离子浓度大小的比较
专题:
分析:A、稀释过程中硫酸的物质的量不变;
B、依据溶液中的物料守恒分析判断,n(Na)=n(C);
C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液为NaCl,HA,NaA溶液,若HA为强酸,溶液呈酸性,若为弱酸取决于A-离子水解程度和HA的电离程度大小,溶液酸碱性不一定,电荷守恒分析等式;
D、氢氧化钡是强碱溶液抑制水的电离,碳酸钠溶液是强碱弱酸盐,碳酸根离子水解促进水的电离.
B、依据溶液中的物料守恒分析判断,n(Na)=n(C);
C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液为NaCl,HA,NaA溶液,若HA为强酸,溶液呈酸性,若为弱酸取决于A-离子水解程度和HA的电离程度大小,溶液酸碱性不一定,电荷守恒分析等式;
D、氢氧化钡是强碱溶液抑制水的电离,碳酸钠溶液是强碱弱酸盐,碳酸根离子水解促进水的电离.
解答:
解:A、室温下,pH=5的硫酸溶液中,c(H+)=1×10-5mol/L,c(SO42-)=5×10-6mol/L,稀释1000倍后,溶液接近中性,但溶液始终为酸性溶液,即溶液的pH无限接近7但永远不能到达7,所以c(H+)=1×10-7mol/L,c(SO42-)=5×10-9mol/L,所以溶液中的SO4 2-与H+的物质的量浓度之比约为 1:20,故A正确;
B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液为NaCl,HA,NaA溶液,若HA为强酸,溶液呈酸性,若为弱酸取决于A-离子水解程度和HA的电离程度大小,溶液酸碱性不一定,电荷守恒c(Na+)+c(H+)=c(A-)+c(Cl-),故C错误;
D、氢氧化钡是强碱溶液抑制水的电离,碳酸钠溶液是强碱弱酸盐,碳酸根离子水解促进水的电离,pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)不相等,故D错误;
故选A.
B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液为NaCl,HA,NaA溶液,若HA为强酸,溶液呈酸性,若为弱酸取决于A-离子水解程度和HA的电离程度大小,溶液酸碱性不一定,电荷守恒c(Na+)+c(H+)=c(A-)+c(Cl-),故C错误;
D、氢氧化钡是强碱溶液抑制水的电离,碳酸钠溶液是强碱弱酸盐,碳酸根离子水解促进水的电离,pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)不相等,故D错误;
故选A.
点评:本题考查电解质溶液中离子浓度大小比较,电荷守恒、物料守恒分析判断,溶液酸碱性的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
用某种仪器量取液体体积时,平视时读数为nmL,仰视时读数为x mL,俯视时读数为y mL,若X>n>y,则所用的仪器可能为( )
| A、量筒 | B、容量瓶 |
| C、滴定管 | D、以上均不对 |
能够在酸性条件下水解,生成相对分子质量相同的两种物质的是( )
| A、纤维素 | B、淀粉 |
| C、蔗糖 | D、麦芽糖 |
将2.4g Fe、Mg 合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g.则收集到的气体体积V值不可能的是( )
| A、0.784 | B、0.896 |
| C、1.00 | D、1.12 |
可逆反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数w(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
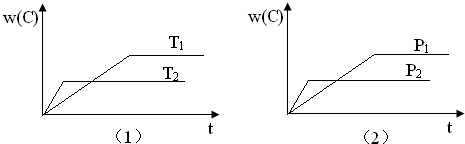

| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
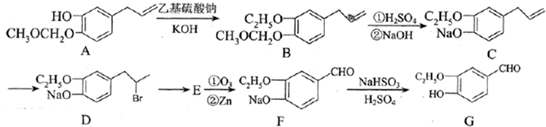
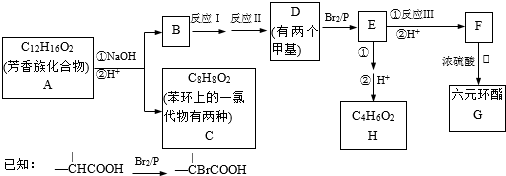
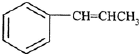 为原料制备
为原料制备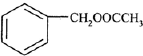 的合成路线流程图(无机试剂
的合成路线流程图(无机试剂