题目内容
 低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.(1)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.现将浓度为2×10-4
mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生 反应为CO2+3H2
| ||
考点:化学平衡的影响因素,化学电源新型电池
专题:
分析:(1)、①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(4)据电子移动方向分析,b为阴极,阴极发生还原反应,CO2在阴极发生还原反应.
②Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(4)据电子移动方向分析,b为阴极,阴极发生还原反应,CO2在阴极发生还原反应.
解答:
解:(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO?N2+CO2;
②Ⅰ、平衡时c(NO)=
=0.02mol/L,c(N2)=c(CO2)=
=0.015mol/L,故T1℃时该反应的平衡常数为K1=
=
,故答案为:
;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,标准状况下8.96L CO2是0.4mol,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物离子方程式为:2CO2+3OH-=HCO3-+CO32-+H2O;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:2CO2+3OH-=HCO3-+CO32-+H2O;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5mol/L;
(4)据电子移动方向分析,b为阴极,阴极发生还原反应,CO2在阴极发生还原反应,电极反应式为:CO2+6H++6e-=CH3OH+H2O,故答案为:CO2+6H++6e-=CH3OH+H2O.
故答案为:C+2NO?N2+CO2;
②Ⅰ、平衡时c(NO)=
| 0.04mol |
| 2L |
| 0.03mol |
| 2L |
| 0.015×0.015 |
| 0.022 |
| 9 |
| 16 |
| 9 |
| 16 |
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,标准状况下8.96L CO2是0.4mol,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物离子方程式为:2CO2+3OH-=HCO3-+CO32-+H2O;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:2CO2+3OH-=HCO3-+CO32-+H2O;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 1×10-4 |
故答案为:5.6×10-5mol/L;
(4)据电子移动方向分析,b为阴极,阴极发生还原反应,CO2在阴极发生还原反应,电极反应式为:CO2+6H++6e-=CH3OH+H2O,故答案为:CO2+6H++6e-=CH3OH+H2O.
点评:本题考查化学方程式书写、平衡常数的计算、离子浓度大小比较、沉淀的溶度积计算、电极反应式书写,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将2.4g Fe、Mg 合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g.则收集到的气体体积V值不可能的是( )
| A、0.784 | B、0.896 |
| C、1.00 | D、1.12 |
下列物质中不属于硅酸盐产品的是( )
| A、陶瓷餐具 | B、水泥 |
| C、普通玻璃 | D、计算机芯片 |
常温常压时,下列叙述不正确的是( )
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| B、pH=5的①NH4Cl溶液②CH3COOH溶液③稀盐酸溶液中c(H+)水:①>②>③ |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D、0.1 mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则b<a+l |
下列叙述正确的是( )
| A、0.1 mol?L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 |
| C、0.1 mol?L-1与0.2 mol?L-1氨水溶液中c(OH-)之比为1:2 |
| D、中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2 |
可逆反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数w(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
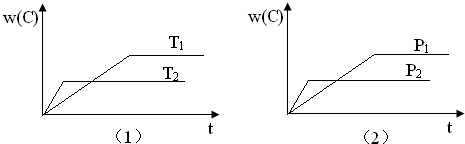

| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
今年我国“天宫一号”空间实验室将与“神舟”载人飞船实现对接.飞船升空所需的巨大能量可由下列化学反应提供:C2H3N2+2N2O4=2CO2+3N2+4H2O.有关该反应的说法正确的是( )
| A、是分解反应 |
| B、是氧化还原反应 |
| C、反应中碳元素的化合价降低 |
| D、氧化剂是C2H3N2 |
化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是( )
| A、纯碱溶液呈碱性的原因是:CO32-+2H2O=H2CO3+2OH- | ||||
B、用惰性电极电解MgCl2溶液:Mg2++2Cl-+2H2O
| ||||
| C、乙烯的结构简式:CH2CH2 | ||||
| D、在原电池和电解池中均可发生的电极反应:4OH--4e-=O2↑+2H2O |