题目内容
3.雾霾严重地威胁着人们生命生存的生态环境.下列有关措施不可行的是( )| A. | 对燃煤进行脱硫,减少向大气排放SO2 | |
| B. | 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中 | |
| C. | 为增加工业产值,大力兴建水泥厂、炼钢厂 | |
| D. | 对汽车等交通工具采用清洁燃料,如天然气、甲醇等 |
分析 A.二氧化硫可导致酸雨发生;
B.SO2、NO2等工业废气污染环境,均可导致酸雨,二氧化氮还可导致光化学烟雾;
C.大力兴建水泥厂、炼钢厂,排放粉尘、废水及污染性气体;
D.天然气、甲醇等,燃烧产物对环境污染小.
解答 解:A.二氧化硫可导致酸雨发生,则对燃煤进行脱硫,减少向大气排放SO2,故A正确;
B.SO2、NO2等工业废气污染环境,均可导致酸雨,二氧化氮还可导致光化学烟雾,则进行无害处理后,再排放到大气中,故B正确;
C.大力兴建水泥厂、炼钢厂,排放粉尘、废水及污染性气体,则不能为增加工业产值,大力兴建水泥厂、炼钢厂,故C错误;
D.天然气、甲醇等,燃烧产物对环境污染小,则对汽车等交通工具采用清洁燃料可保护环境,故D正确;
故选C.
点评 本题考查环境污染,为高频考点,把握常见的环境污染物及环境问题为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
13.认识反应条件对化学反应的影响,对学好化学具有重要意义.下列说法中正确的是( )
| A. | 偏铝酸钠溶液中加入一定量的盐酸,最终一定得到Al(OH)3沉淀 | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 向NaOH溶液中通入少量CO2或过量CO2都只生成Na2CO3 | |
| D. | 氯化铝和少量的氨水或过量的氨水反应都得到Al(OH)3沉淀 |
14.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中正确的是( )
| A. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr | |
| B. | Fe与Cl2反应生成FeCl2,推测Fe与I2反应生成FeI3 | |
| C. | 不能电解AlCl3溶液来制取金属铝:推测也不能用电解MgCl2溶液来制取金属镁 | |
| D. | CO2与Na2O2反应只生成Na2O3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
18.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
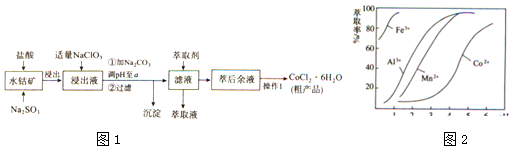
已知:
①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表(金属离子浓度为0.01mol/L):
③CoCI2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)惰性电极电解CoCl2溶液的阳极电极反应式为2Cl--2e-=Cl2↑.(注:横坐标依次为1-6;单位PH)
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是除去锰离子,其使用的最佳pH范围是B.
A. 2.0~2.5B. 3.0~3.5C. 4.0~4.5D. 5.0~5.5
(6)力测定粗产品中CoCl2•H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:
①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表(金属离子浓度为0.01mol/L):
| 淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)惰性电极电解CoCl2溶液的阳极电极反应式为2Cl--2e-=Cl2↑.(注:横坐标依次为1-6;单位PH)
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是除去锰离子,其使用的最佳pH范围是B.
A. 2.0~2.5B. 3.0~3.5C. 4.0~4.5D. 5.0~5.5
(6)力测定粗产品中CoCl2•H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
8.化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能,根据键能数据估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为:( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +485 kJ•mol-1 | B. | -485 kJ•mol-1 | C. | +1940 kJ•mol-1 | D. | -1940 kJ•mol-1 |
15.下列化学反应过程不符合如图关系的是( )
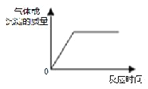

| A. | 向一定量铜片中加入过量浓硝酸 | |
| B. | .向一定量AlCl3溶液通入过量NH3 | |
| C. | .向一定量澄清石灰水中通入过量CO2 | |
| D. | .向一定量MgCl2溶液中滴加过量NaOH |
12.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.对此反应下列说法中正确的是( )
| A. | 2 mol FeSO4发生反应时,反应中共有10 mol电子转移 | |
| B. | 每生成16g氧气就有1molFe2+被还原 | |
| C. | Na2O2只作氧化剂 | |
| D. | 氧化产物只有Na2FeO4 |
8.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(石墨)=C(金刚石)△H=1.9kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,则向含0.1mol/L的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | |
| D. | 2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
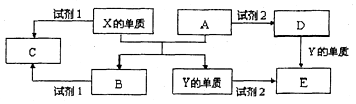 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.