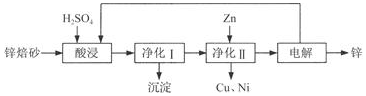
题目内容
8.下列有关能量的判断或表示方法正确的是( )| A. | 从C(石墨)=C(金刚石)△H=1.9kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,则向含0.1mol/L的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | |
| D. | 2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
分析 A.物质具有的能量越低越稳定;
B.硫固体转化为硫蒸气的过程是吸热该过程,硫的燃烧过程是放热过程;
C.HCl的物质的量不知道;
D.根据热化学方程式的意义和书写方法来判断.
解答 解:A.从C(石墨)═C(金刚石)△H=+1.9kJ/mol,可知石墨具有的能量较低,物质具有的能量越低越稳定,所以石墨比金刚石更稳定,故A错误;
B.硫固体转化为硫蒸气的过程是吸热该过程,硫蒸气和硫固体分别完全燃烧,硫蒸气放出热量更多,故B错误;
C.向含0.1mol/L的盐酸中加入4.0 gNaOH固体,由于盐酸的体积不知道,无法计算HCl的物质的量,所以反应放出的热量无法计算,故C错误;
D.2gH2即1molH2完全燃烧生成液态水放出285.8kJ热量,则2molH2燃烧放出的热量285.8kJ×2=571.6KJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2 H2O(l)△H=-571.6kJ/mol,故D正确.
故选D.
点评 本题考查化学反应的反应热和焓变间的关系知识,注意中和热的测定实验中使用的是强酸和强碱的稀溶液,题目难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
3.雾霾严重地威胁着人们生命生存的生态环境.下列有关措施不可行的是( )
| A. | 对燃煤进行脱硫,减少向大气排放SO2 | |
| B. | 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中 | |
| C. | 为增加工业产值,大力兴建水泥厂、炼钢厂 | |
| D. | 对汽车等交通工具采用清洁燃料,如天然气、甲醇等 |
4.铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐可能是( )
| A. | FeC13 | B. | Na2CO3 | C. | KNO3 | D. | FeSO4 |
3.下列说法正确的是( )
| A. | 苯和己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | C2H6和C9H20一定互为同系物 | |
| C. | 乙醇与乙酸在加热条件下、由稀硫酸催化可以生成乙酸乙酯 | |
| D. | 新戊烷和异丁烷的一氯代物均为一种 |
20.下列能正确表示氧的原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
18.下列叙述不正确的是( )
| A | B | C | D |
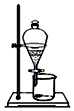 |  |  |  |
| 用酒精萃取碘水中的碘 | 烧杯中的Fe(OH)3胶体可产生丁达尔效应 | 蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 | Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
| A. | A | B. | B | C. | C | D. | D |