题目内容
8.化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能,根据键能数据估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为:( )| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +485 kJ•mol-1 | B. | -485 kJ•mol-1 | C. | +1940 kJ•mol-1 | D. | -1940 kJ•mol-1 |
分析 焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:由表格中键能及CH4(g)+4F2(g)=CF4(g)+4HF(g)可知,其△H=(414kJ/mol)×4+(155kJ/mol)×4-(489kJ/mol)×4-(565kJ/mol)×4=-1940 kJ•mol-1,
故选D.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意化学键数目的判断,题目难度不大.

练习册系列答案
相关题目
18.某烧杯中盛有含0.1mol (NH4)Al(SO4)2的溶液,现向其中缓缓加入2mol•L-1 NaOH溶液200mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2-和Al(OH)3 | D. | AlO2- |
16.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体.下列指定溶液中微粒浓度大小比较正确的是( )
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
3.雾霾严重地威胁着人们生命生存的生态环境.下列有关措施不可行的是( )
| A. | 对燃煤进行脱硫,减少向大气排放SO2 | |
| B. | 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中 | |
| C. | 为增加工业产值,大力兴建水泥厂、炼钢厂 | |
| D. | 对汽车等交通工具采用清洁燃料,如天然气、甲醇等 |
13.如图为实验室制取氨气的实验装置图.下列说法错误的是( )
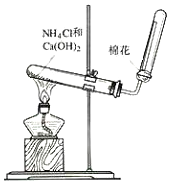

| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
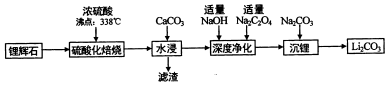
17.碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图:
已知:碳酸锂的溶解度为((g/L)
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为((g/L)
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.
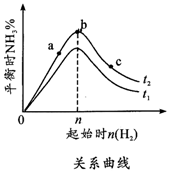 (1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).
(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).