题目内容
3.铜陵有色金属集团公司是电解铜产量全国第一的大型企业.其冶炼工艺中铜、硫回收率达到97%、87%.图表示其冶炼加工的流程:
冶炼中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(1)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图:
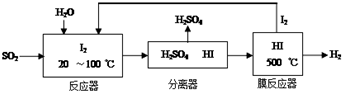
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M═NiO(OH)+MH,电池放电时,负极电极反应式为MH+OH--e-=H2O+M; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为O2+4e-+2H2O=4OH-.
(2)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解.
几种物质的溶度积常数(Ksp)
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是将Fe2+氧化为Fe3+.加入H2O2后发生反应的离子方程式为2Fe2++2H++H2O2=2Fe2++2H2O.
分析 (1)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动;
③负极反应物MH失去电子,生成的H+在碱性条件下生成H2O;由题意知氧气在阴极上被还原,电解质溶液呈碱性可知氧气被还原为OH-;
(2)根据溶度积越大溶解度越大,随pH升高最先沉淀的是对应强氧化物的溶度积最小的离子分析;加入双氧水能够将亚铁离子氧化成铁离子,据此写出反应的离子方程式.
解答 解:(1)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解反应为可逆反应,则使用膜反应器分离出H2的目的是及时分离出产物H2,有利于反应正向进行,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
③负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M,阴极的电极反应有两个,第一阶段是充电时的反应式,阴极上电极反应式为M+H2O+e-═MH+OH-,第二阶段为吸收氧气的电极反应式,由题意知氧气在阴极上被还原,电解质溶液呈碱性可知氧气被还原为OH-,所以其电极反应式为2H2O+O2+4e-═4OH-.
故答案为:MH+OH--e-=H2O+M;O2+4e-+2H2O=4OH-;
(2)①根据表中氢氧化物的溶度积可知,氢氧化铁的溶度积最小,其溶解度最小,所以随pH升高最先沉淀下来的离子是铁离子,故答案为:Fe3+;
②双氧水能够将溶液中的亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:将Fe2+氧化为Fe3+;2Fe2++2H++H2O2=2Fe2++2H2O.
点评 本题主要考查了工业电解冶炼金属铜原理、物质的分离和提纯、离子方程的书写,为高考常见题型,题目难度中等,注意掌握电解原理、物质的分离和提纯方法,试题培养了学生的分析、理解能力和实验设计能力.

 优等生题库系列答案
优等生题库系列答案| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) |
| A. | 在10g质量分数为46%的乙醇水溶液中含有H原子数目为1.2NA | |
| B. | 标准状况下22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| C. | 4.0gH2与足量O2完全反应生成水,反应中断裂共价键数目为2NA | |
| D. | 常温常压下,将0.1molFe投入足量浓硝酸中,转移电子数为0.3NA |
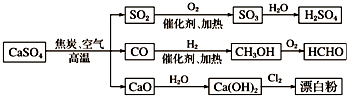
| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH,原子利用率为100% |
| A. | 有机物 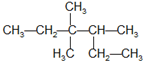 的系统命名为3,3-二甲基-2-乙基戊烷 的系统命名为3,3-二甲基-2-乙基戊烷 | |
| B. | 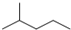 的一氯取代物的同分异构体有6种 的一氯取代物的同分异构体有6种 | |
| C. | 在相同条件下,等物质的量的乙烯和乙醇完全燃烧消耗的氧气体积相等 | |
| D. | 蔗糖、淀粉、纤维素、聚乙烯都属于高分子化合物 |
| A. | 放电时,正极发生的反应是 Pb+SO4+2e═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变大 | |
| D. | 放电时,每当消耗 1 mol 铅时转移电子 4 mol |

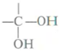 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
.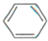 +
+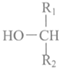 $\stackrel{酶}{→}$
$\stackrel{酶}{→}$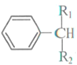 +H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式
+H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式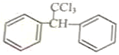 .
.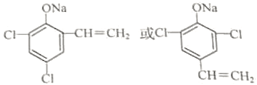 (任写一种)
(任写一种)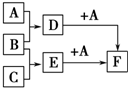 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.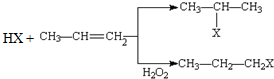 (X为卤素原子)
(X为卤素原子)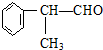 的物质,该物质是一种香料.
的物质,该物质是一种香料.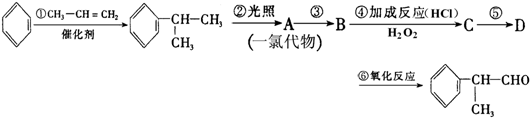
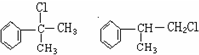 ;
;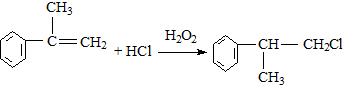 ;
;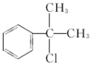 的水解产物
的水解产物 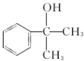 ,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度;
,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度; 等任意一种.
等任意一种.