题目内容
8.下列说法正确的是( )| A. | 有机物 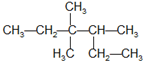 的系统命名为3,3-二甲基-2-乙基戊烷 的系统命名为3,3-二甲基-2-乙基戊烷 | |
| B. | 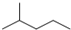 的一氯取代物的同分异构体有6种 的一氯取代物的同分异构体有6种 | |
| C. | 在相同条件下,等物质的量的乙烯和乙醇完全燃烧消耗的氧气体积相等 | |
| D. | 蔗糖、淀粉、纤维素、聚乙烯都属于高分子化合物 |
分析 A.主链错误,应有6个C原子;
B. 中有5种不同的H原子;
中有5种不同的H原子;
C.可将乙醇拆写成C2H4•H2O的形式来分析;
D.根据高分子化合物的定义判断.
解答 解:A.主链错误,应有6个C原子,正确命名为3,3,4-三甲基-己烷,故A错误;
B. 中有5种不同的H原子,一氯取代物的同分异构体有5种,故B错误;
中有5种不同的H原子,一氯取代物的同分异构体有5种,故B错误;
C.乙醇可拆写成C2H4•H2O的形式,物质的量相同的C2H4和C2H4•H2O完全燃烧时,消耗氧气的量相同,故C正确;
D.高分子化合物的相对分子质量一般在10000以上,蔗糖不是高分子化合物,故D错误.
故选C.
点评 本题考查有机物结构和性质、化学方程式的有关计算,为高频考点,侧重考查学生分析判断及计算能力,注意高分子化合物的判断以及有机物的命名,难度不大.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
19.下列有关溶液中离子存在和转化的表达合理的是( )
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
16. 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
3.铜陵有色金属集团公司是电解铜产量全国第一的大型企业.其冶炼工艺中铜、硫回收率达到97%、87%.图表示其冶炼加工的流程:

冶炼中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(1)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图:
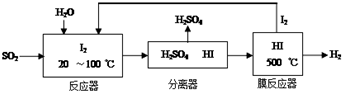
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M═NiO(OH)+MH,电池放电时,负极电极反应式为MH+OH--e-=H2O+M; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为O2+4e-+2H2O=4OH-.
(2)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解.
几种物质的溶度积常数(Ksp)
①调节电解液的pH是除去杂质离子的常用方法.根据上表中溶度积数据判断,含有等物质的量浓度Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是Fe3+.
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是将Fe2+氧化为Fe3+.加入H2O2后发生反应的离子方程式为2Fe2++2H++H2O2=2Fe2++2H2O.

冶炼中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(1)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图:

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M═NiO(OH)+MH,电池放电时,负极电极反应式为MH+OH--e-=H2O+M; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为O2+4e-+2H2O=4OH-.
(2)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解.
几种物质的溶度积常数(Ksp)
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是将Fe2+氧化为Fe3+.加入H2O2后发生反应的离子方程式为2Fe2++2H++H2O2=2Fe2++2H2O.
20.通过NO传感器可监测NO的含量,其工作原理如图所示.下列说法错误的是( )

| A. | 该装置实现化学能向电能的转化 | |
| B. | 该电池的总反应为2NO+O2═2NO2 | |
| C. | 当有2.24L的O2参与反应时,转移了0.4mole- | |
| D. | NiO电极的电极反应式:NO+O2--2e-═NO2 |
17.生活中处处有化学,下列相关表述正确的是( )
| A. | 苯酚对皮肤有腐蚀性 | B. | 乙醇是不可再生的能源 | ||
| C. | 质量分数100%的酒精为医用酒精 | D. | 天然橡胶的主要成分是异戊二烯 |
4.下列有关实验的描述正确的是( )


| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置电解精炼铝 | |
| C. | 用图3装置乙醇脱水制乙烯 | |
| D. | 用图4装置定量测定化学反应速率 |
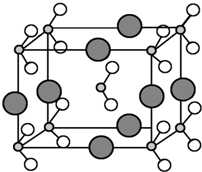 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
