题目内容
12. 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.(1)与C同主族的元素Ge位于第四周期,其原子核外电子排布式为1s22s22p63s23p63d104s24p2
(2)Na、C、N的第一电离能由大到小的顺序为N>C>Na.
(3)CN-中C原子的杂化轨道类型是sp,写出一个与CN-具有相同空间构型和键合形式的分子:N2(填分子式).
(4)NaCN可用于Au的提取:4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaOH.Na[Au(CN)2]中的配离子为[Au(CN)2]+,0.1mol配离子中含有的σ键数为0.4NA(用NA表示阿伏加德罗常数的值)
(5)NaCN的晶胞结构如图所示,晶胞中Na+与CN-之间的距离为acm,晶胞中Na+的配位数为6,则NaCN的密度为$\frac{49}{2{a}^{3}{N}_{A}}$g•cm-3(用NA表示阿伏加德罗常数的值).
分析 (1)与C同主族的元素Ge位于第四周期IVA族,根据能量最低原理书写核外电子排布式;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,同主族自上而下第一电离能减小;
(3)CN-与氮气分子互为等电子体,CN-中C原子与N原子之间形成3对共用电子对、含有1对孤对电子,杂化轨道数目为2;
(4)Na[Au(CN)2]中的配离子为[Au(CN)2]+,该配离子中形成2个配位键、CN-中形成1个三键,离子中含有4个σ键;
(5)以体心Na+研究,与之相邻的CN-位于面心,晶胞中Na+与CN-之间的距离为a cm,则晶胞棱长为2a cm,计算晶胞体积,根据均摊法计算晶胞中晶胞中Na+、CN-离子数目,再表示出晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)与C同主族的元素Ge位于第四周期IVA族,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s24p2,
故答案为:1s22s22p63s23p63d104s24p2;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,Na、C、N的第一电离能由大到小的顺序为:N>C>Na,
故答案为:N>C>Na;
(3)CN-与氮气分子互为等电子体,与N2分子具有相同空间构型和键合形式,CN-中C原子与N原子之间形成3对共用电子对、含有1对孤对电子,杂化轨道数目为2,C原子采取sp杂化,
故答案为:sp;N2;
(4)Na[Au(CN)2]中的配离子为[Au(CN)2]+,该配离子中形成2个配位键、CN-中形成1个三键,离子中含有4个σ键,0.1mol配离子中含有的σ键数为0.4NA,
故答案为:[Au(CN)2]+;0.4NA;
(5)以体心Na+研究,与之相邻的CN-位于面心,晶胞中Na+的配位数为6,晶胞中Na+与CN-之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3,晶胞中Na+离子数目为1+12×$\frac{1}{4}$=4、CN-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{49}{{N}_{A}}$g,则晶胞密度为4×$\frac{49}{{N}_{A}}$g÷(2a cm)3=$\frac{49}{2{a}^{3}{N}_{A}}$g.cm-3,
故答案为:6;$\frac{49}{2{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式、等电子体、配合物、晶胞结构与计算等,注意同周期第一电离能异常情况,掌握均摊法进行晶胞有关计算,难度中等.

 名校课堂系列答案
名校课堂系列答案| 物质类别 | 具体物质 | 物质类别 | 具体物质 |
| 压缩气体和液化气体 | 氩气、压缩天然气易燃固体、自然物品和遇湿易燃物品 | 硫磺、硝化纤维素、电石、硅钙合金、钠、钾 | |
| 氧化剂和有机过氧化物 | 硝酸钾、硝酸钠、过氧乙酸 | 易燃液体 | 甲乙酮、乙酸乙酯 |
| 腐蚀品、杂类 | 甲酸、磷酸、甲基磺酸、烧碱、硫化碱 | 毒害品 | 氰化钠、甲苯二异氰酸酯 |
(1)压缩气体和液化气体中属于单质的是Ar、S、Na、K,天然气的主要成分是CH4,按物质树状分类法,天然气属于混合物;
(2)氧化剂和有机过氧化物中,硝酸钾、硝酸钠均属于A;
A.硝酸盐 B.氧化物 C.钾盐 D.钠盐
(3)在毒害品中含有剧毒化学品氰化钠(NaCN).下列有关氰化钠的说法中错误的是B;
A.NaCN易溶于水
B.NaCN中碳元素的化合价为+4
C.可用H2O2将NaCN还原为无毒物质
D.为防止中毒,须加强对地表水、排海口等位置水体中氰化物的排查监测
(4)写出易燃固体中金属钾与水反应的离子方程式:2K+2H2O=2K++2OH-+H2↑;
(5)腐蚀品中烧碱的主要成份是NaOH,如在实验室中配制500mL浓度为0.2mol•L-1的烧碱溶液,需称量烧碱4.0g.需要的玻璃仪器.除了烧杯、玻璃棒外,还必须有500ml容量瓶、胶头滴管.
| A. | Na2O2与H2O反应过程中有离子键、非极性键、极性键的断裂和形成 | |
| B. | 1molNH4+中含有的共用电子对为3mol | |
| C. | N2属于单质,不存在化学键 | |
| D. | 离子化合物中一定含有金属元素 |
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
0.06mol•L-1•h-1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动?向右移动 (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为B(填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为0.8.
(4)在100℃条件下,能说明反应CCl4+H2?CHCl3+HCl△H<O达到平衡状态的是D(填字母).
A.压强不再变化
B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变
D.H2的质量不再变化
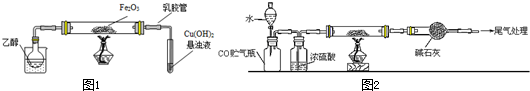
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理
简单,设备占地面积小,废水中的重金属离子也能通过电解有所降
低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,
其装置示意图如图所示.
①若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入甲醚,a极的电极反应为13O2+52e-=26O2-.
②能否用铜作电解重铬酸钠废水的电极?不能(填“能”或“不能”),理由是铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬
③除去重铬酸根离子的离子反应是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
Ⅰ.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g)?CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | 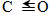 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为Ⅰ (填曲线标记字母),其判断理由是反应为放热反应,升高温度,平衡逆向移动,平衡常数数值及平衡常数的对数lgK随温度升高变小.
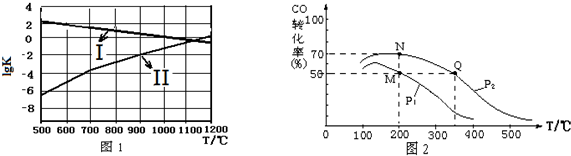
(3)在密闭容器中充有10mol CO与20mol H2,CO的平衡转化率与温度、压强的关系如图2.
①P1小于P2(填“大于”或“小于”),其判断理由是相同温度下,由于反应为气体分子数减小的反应,加压有利于平衡正移,提升CO的转化率,故P1<P2.
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为ν(M)<ν(N)<ν(Q).
③M、N、Q三点平衡常数KM、KN、KQ大小关系为KM=KN>KQ.
Ⅱ.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图3所示.已知:气体分压(P分)=气体总压(P总)×体积分数.
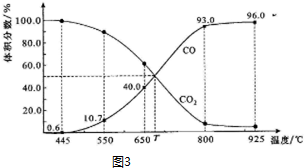
(1)完成下列填空:
①650℃时,反应达平衡后CO2的转化率为25.0%.
②T℃时,若充入等体积的CO2和CO,平衡不移动(填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=$\frac{1}{96}$MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP=0.24 MPa.
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
| A. | 乙烯 | B. | 二氧化硫 | C. | 氢气 | D. | 乙烷 |