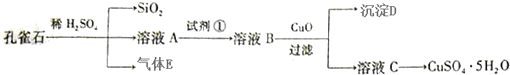
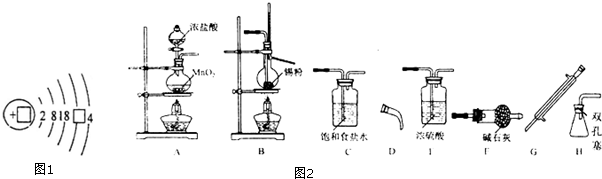
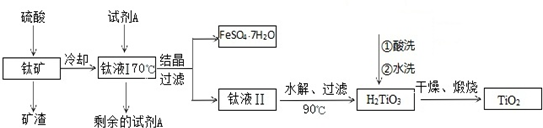
题目内容
7.下列关于氧化还原反应中电子转移数目的判断正确的是( )| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
分析 A、Cl2与足量的NaOH溶液反应:Cl2+2NaOH=NaClO+NaCl+H2O,氧化剂还原剂都是氯气;
B、0.1molZn与含0.1molHCl的盐酸充分反应,盐酸全反应,金属锌剩余;
C、1molNa与足量O2反应,金属钠全部转化为+1价的钠离子,据此计算转移的电子数;
D、向FeI2溶液中通入适量Cl2,先将碘离子氧化,然后将亚铁离子氧化.
解答 解:A、Cl2与足量的NaOH溶液反应:Cl2+2NaOH=NaClO+NaCl+H2O,1mol Cl2与足量的NaOH溶液反应,转移的电子数为NA,故A错误;
B、0.1molZn与含0.1molHCl的盐酸充分反应,盐酸全反应,金属锌剩余,转移的电子数目为0.1NA,故B错误;
C、1molNa与足量O2反应,金属钠全部转化为+1价的钠离子,转移的电子数为NA,故C正确;
D、向FeI2溶液中通入适量Cl2,先将碘离子氧化,然后将亚铁离子氧化,当有1molFe2+被氧化时,共转移的电子的数目大于NA,故D错误.
故选C.
点评 本题考查了氧化还原反应中电子转移以及阿伏伽德罗常数的有关计算知识,熟练掌握公式的使用和基本概念是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列表示甲基的电子式中,正确的是( )
| A. | 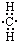 | B. | 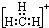 | C. | 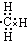 | D. | 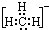 |
2.下列物质中,不能使酸性KMnO4溶液褪色的物质是( )
① ②乙烯③SO2 ④氯乙烯
②乙烯③SO2 ④氯乙烯
⑤CH2═CH-COOH ⑥苯 ⑦聚乙烯.
①
 ②乙烯③SO2 ④氯乙烯
②乙烯③SO2 ④氯乙烯⑤CH2═CH-COOH ⑥苯 ⑦聚乙烯.
| A. | ①⑥⑦ | B. | ①③④⑥ | C. | ①④⑦ | D. | ①③⑥⑦ |
16.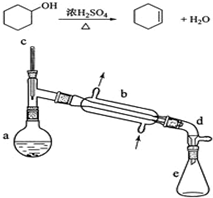 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙
颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是圆底烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A.圆底烧瓶 B.温度计 C.漏斗 D.球形冷凝管 E.接收器
(6)本实验所得到的环己烯产率是61%.(保留两位有效数字)
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙
颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是圆底烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A.圆底烧瓶 B.温度计 C.漏斗 D.球形冷凝管 E.接收器
(6)本实验所得到的环己烯产率是61%.(保留两位有效数字)
17.下列反应属于吸热反应的是( )
| A. | 碳酸钙受热分解 | B. | 氧化钙溶于水 | C. | 甲烷燃烧 | D. | 铝粉与盐酸反应 |
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.